|
Ômega-conotoxina MVIIC no trauma experimental da medula espinhal em ratos1
ARTÍCULO DE INVESTIGACIÓN
Juan Sebastian Gutiérrez-Lozano2
1 Financiado pelo Conselho Nacional de Desenvolvimento de Ciencia e Tecnologia. 2 Universidade Federal de Mina Gerais, Belo Horizonte, Brasil. 3 Instituto de Ensino e Pesquisa Santa Casa, Belo Horizonte, Brasil.
This email address is being protected from spambots. You need JavaScript enabled to view it.
Recibido: 09 de agosto de 2018, Aprobado: 15 de noviembre de 2018 y Actualizado: 27 de diciembre de 2018
DOI: 10.17151/vetzo.2019.13.1.8
RESUMO. Introdução: As lesões medulares causam danos no tecido nervoso por mecanismos primário e secundário. A lesão primaria e de tipo irreversível, já no mecanismo secundário um influxo exacerbado de cálcio é produzido, sendo o passo mais crítico depois da lesão da medula espinhal, principalmente devido à ativação de canais para cálcio voltagem-dependentes. Esse evento é considerado crítico na fisiopatogênia da lesão medular, reduzir o influxo de cálcio deveria resultar numa melhora da lesão medular, já que tem sido demostrado que os bloqueadores de canais de cálcio têm um alto potencial para reduzir as lesões. Objetivos: avaliar o efeito neuroprotetor da Ômega-conotoxina MVIIC obtida do veneno de Conus magus é capaz de bloquear ditos canais e, assim, reduzir o influxo de cálcio. O presente estudo avaliou o efeito da aplicação intratecal da toxina nas doses 15 e 30 pmol e nos tempos 5 minutos e uma hora após o trauma medular experimental em ratos. Métodos: Foram utilizados 36 ratos machos adultos, variedade Wistar, aleatoriamente divididos em seis grupos. Os animais do grupo controle negativo foram submetidos à laminectómica dorsal. Nos demais grupos, além da laminectómica, os animais foram submetidos ao trauma medular agudo contusivo pelo aparelho MASCIS impactor. Realizou-se aplicação intratecal de placebo nos animais dos grupos controle positivo. Nos grupos G3 e G5 foram aplicadas doses de 15 e 30 pmol, respectivamente, da toxina, nos animais tratados 5 minutos após o trauma. Nos grupos G4 e G6 foram aplicadas as doses de 15 e 30, respectivamente, uma hora após o trauma. Coletaram-se segmentos de medula espinhal, para quantificação de espécies reativas de oxigênio e peroxidação lipídica e para a avaliação da expressão gênica de fatores relacionados à apoptose por meio de técnica de qRT-PCR. Resultados: Não foram encontradas diferenças diferenciadas para os tratamentos avaliados com relação à produção de radicais livres e às reações da peroxidação lipídica. Sem embargo, o uso de 15 pmol de ômega-conotoxina MVIIC é uma hora após o trauma, que é mais grave que as outras doses avaliadas. Conclusões: A ômega-conotoxina MVIIC pode ser útil para o tratamento do trauma da medula espinal em ratas. Sem embargo, consulte mais estudos para determinar a dose recomendada para este sustento
Palavras-chave: apoptose, ômega-conotoxina, neuroproteção, qRT-PCR em tempo real, traumatismo da medula espinhal
Omega-conotoxina MVIIC en trauma experimental de médula espinal en ratas
RESUMEN. Introduccion: Las lesiones de la médula espinal causan daño al tejido nervioso por mecanismos primarios y secundarios. La lesión de tipo primario es irreversible, que ya se encuentra en el mecanismo secundario y produce una entrada de calcio exacerbada, siendo el paso más crítico después de la lesión de la médula espinal, principalmente debido a la activación de los canales de calcio activados por voltaje. Este evento se considera crítico en la fisiopatología de la lesión de la médula espinal, puesto que la entrada de calcio debería mejorar la lesión, ya que se ha demostrado que los bloqueadores de los canales de calcio tienen un alto potencial para reducir las lesiones. Objetivos: evaluar el efecto neuro protector de omega conotoxina MVIIC obtenida de la venus de Conus magus es capaz de bloquear estos canales y así reducir la entrada de calcio. El presente estudio evaluó el efecto de la aplicación de toxina intratecal a dosis de 15 y 30 pmoles a los 5 minutos y una hora después del trauma experimental de la médula espinal en ratas. Metodologia: Treinta y seis ratas Wistar macho adultas se dividieron al azar en seis grupos. Los animales en el grupo de control negativo se sometieron a una laminectomía dorsal. En los otros grupos, además de la laminectomía, los animales fueron sometidos a un traumatismo contuso agudo de la médula espinal usando el aparato impactor MASCIS. La aplicación intratecal de placebo se realizó en los animales de los grupos de control positivo. En los grupos G3 y G5 de animales tratados 5 minutos después del trauma se aplicaron dosis de 15 y 30 pmoles de la toxina respectivamente. En los grupos G4 y G6 de animales tratados una hora después del trauma se aplicaron dosis de 15 y 30 pmoles respectivamente. Se recogieron segmentos de la médula espinal para cuantificar las especies reactivas de oxígeno y la peroxidación lipídica y para evaluar la expresión génica de factores relacionados con la apoptosis mediante la técnica qRT-PCR. Resultados: No se encontraron diferencias significativas para los tratamientos evaluados con respecto a la producción de radicales libres y las reacciones de la peroxidación lipídica. Sin embargo, el uso de 15 pmol de omega-conotoxina MVIIC una hora después del trauma fue mejor que las otras dosis evaluadas. Conclusiones: Omega-conotoxina MVIIC podría ser útil para el tratamiento del trauma de la médula espinal en ratas. Sin embargo, se necesitan más estudios para determinar la dosis adecuada de esta sustancia
Palabras clave: apoptosis, omega-conotoxina, neuroprotección, qRT-PCR en tiempo real, traumatismo medular
Omega-conotoxin MVIIC on experimental spinal cord trauma in rats
ABSTRACT. Introduction: Spinal cord lesions produce an exacerbated calcium input, being the most critical step after the spinal cord injury, mainly due to the activation of voltage-dependent calcium channels. Thus, calcium channel blockers could have a high potential to reduce spinal cord injuries. Aim: To evaluate the neuroprotective effect of omega-conotoxin MVIIC obtained from the poison of Conus magus in rats with spinal cord trauma. Methods: Thirty-six adult, male, Wistar rats were randomly divided into six groups. Animals in the negative control group underwent dorsal laminectomy. In the other groups, in addition to laminectomy, the animals underwent acute bruised trauma using the MASCIS impactor. Intrathecal placebo application was performed in the animals of the positive control groups. In groups G3 and G5 doses of 15 and 30 pmol of the Omega-conotoxin toxin MVIIC were applied, respectively, in the treated animals, 5 minutes after the trauma. In groups G4 and G6, doses of 15 and 30 pmol were applied, respectively, one hour after the trauma. Segments of the spinal cord were collected to quantify reactive oxygen species and lipid peroxidation, and to assess gene expression of factors related to apoptosis using a qRT-PCR technique. Results: No significant differences were found for the treatments evaluated regarding the free radical production and reactions of lipid peroxidation. However, the use of 15 pmol of omega-conotoxin MVIIC 1 hour after trauma tended to be better than the other evaluated doses. Conclusions: Omega-conotoxin MVIIC could be useful for the treatment of spinal cord trauma in rats. However, further studies are necessary to determine the adequate dose of this substance.
Key words: apoptosis, omega-conotoxin, neuroprotection, qRT-PCR in real time, spinal cord trauma
Introdução
Na medicina veterinária, o trauma medular é um dos problemas neurológicos mais comuns em animais domésticos, apesar de sua incidência real não ser bem documentada (Brouns, 2009). O trauma medular tem adquirido grande importância devido ao fato do sistema nervoso central, diferente do sistema nervoso periférico, apresentar alterações irreversíveis que vão impedir o restabelecimento do tecido neuronal lesado (Bandtlow, 2000). Quando ocorre uma lesão medular, o dano inicial localiza-se no epicentro levando a uma deformação secundária e compressão persistente, o que desencadeará interrupção dos axônios, da microvasculatura e das membranas celulares, levando a morte celular primária com alterações vasculares progressivas dando início a lesão medular secundária (Ballesteros et al., 2012). Os eventos fisiopatológicos no trauma medular secundário existem três fases: fase aguda, fase subaguda e fase crônica. A fase aguda começa imediatamente após o trauma. Nessa fase, a injúria mecânica provoca hemorragia, redução no fluxo sanguíneo, o que posteriormente leva a necrose isquêmica e a falha da função neuronal. Além disso, iniciam-se a liberação de citocinas pró-inflamatórias, o processo de ativação de células da micróglia e a migração de neutrófilos e monócitos para o foco da lesão. Na fase subaguda, a reação inflamatória persiste e a produção de radicais livres aumenta consideravelmente. Essas alterações secundárias provocam peroxidação lipídica, induzem apoptose em neurônios e oligodendrócitos, o que culmina com perda de tecido.
Estratégias farmacológicas neuroprotetoras vêm sendo desenvolvidas na tentativa de interromper ou reduzir a lesão secundária e com isso melhorar a função neurológica dos pacientes com trauma medular. Os agentes bloqueadores de canais para cálcio mostram-se com grande potencial na redução de injúrias cerebrais e medulares, por impedir o influxo exacerbado desse íon, e assim, prevenir a progressão da lesão secundária (Choi, 1992; Lanz et al., 2000). As conotoxinas têm como alvo canais de cálcio voltagem dependentes (CCVD), chamando atenção pela sua capacidade de diminuir os processos na cascata do trauma medular secundário (Garateix et al., 2003; Essack et al., 2012). As ômega-conotoxinas são específicas para CCVD (Oliveira, 2014).
A MVIIC é uma toxina da família das ω-conotoxinas de caramujos marinhos da espécie C. magus (Oliveira, 2012). A ômega-conotoxina MVIIC é um bloqueador seletivo e reversível dos canais para cálcio voltagem dependente do tipo N e P/Q (Liu et al., 1996; Sato et al., 1997; McDonough et al., 2002) e, por isso, consegue inibir a liberação de neurotransmissores que determinarão a progressão da lesão medular secundária (Minami et al., 2001). Portanto, o presente estudo objetivou avaliar os efeitos das doses de 15 e 30 pmol da ômega-conotoxina MVIIC cinco minutos e uma hora após do trauma medular agudo, pela via intratecal por meio de avaliações clínica e laboratorial de toxicidade, classificação da locomoção em campo aberto, quantificação de espécies reativas de oxigênio, peroxidação lipídica e avaliação da expressão gênica de fatores relacionados a apoptose.
Material e Métodos
O presente trabalho foi desenvolvido no Departamento de Clínica e Cirurgia Veterinárias da Universidade Federal de Minas Gerais (UFMG), do Instituto de Ensino e Pesquisa da Santa Casa de Minas Gerais (IEP-SCBH).
Animais
Foram utilizados 36 ratos machos da espécie Rattus norvegicus, linhagem Wistar, de aproximadamente três meses de idade, com peso médio de 350 g, provenientes do Biotério da Faculdade de Farmácia da UFMG. Foram mantidos no Centro Experimental da EV/UFMG, acondicionados em caixas plásticas de dimensões 17cm x 41cm x 33cm. Os animais foram submetidos a ciclos de claro-escuro de 12 horas (07:00 - 19:00), em ambiente com temperatura controlada (22±2°C) receberam ração comercial para roedores. Os animais permaneceram 14 dias para desverminação com tiabendazol (100 mg/kg por via oral). Durante todo o período experimental, receberam ração comercial para roedores e água ad libitum.
A toxina MVIIC
A ω-conotoxina MVIIC com apresentação comercial liofilizada, (Latoxan, França), na dose de 100µg. A toxina foi suspensa em solução de PBS estéril e o volume ajustado para 30 pMol/μL e 15 pMol/μL, e conservada em freezer (-20°C) até o momento da aplicação.
Grupos experimentais
Os 36 animais foram aleatoriamente divididos em seis grupos experimentais: controle negativo (CN), controle positivo (CP), ω-conotoxina MVIIC na dose de 15 pmol após 5 minutos (MVIIC 15-5), ω-conotoxina MVIIC na dose de 15 pmol após 60 minutos (MVIIC 15-60), ω-conotoxina MVIIC na dose de 30 pmol após 5 minutos (MVIIC 30-5) e ω-conotoxina MVIIC na dose de 30 pmol após 60 minutos (MVIIC 30-60).
Procedimentos anestésico e cirúrgico e cuidados pós-operatórios
Após pesagem dos animais, foi realizada antibioticoprofilaxia com cefalotina sódica (60 mg/kg via IM), medicação pré-anestésica e analgesia com sulfato de morfina (5 mg/kg via IM), 30 minutos antes do procedimento cirúrgico. Em seguida, a indução anestésica foi realizada em câmara com isoflurano e a manutenção com o mesmo agente anestésico.
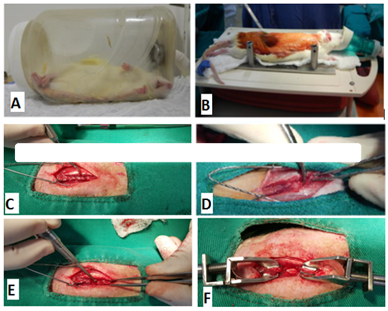
Após a tricotomia e anti-sepsia da região dorsal do tronco com iodopovidona degermante e álcool iodado, os ratos foram posicionados no dispositivo indutor de trauma da medula espinhal MASCIS Impactor. Foi realizada a ostectomia do processo espinhoso e da lâmina dorsal de T12, fazendo o desgaste com drill pneumático neurológico e, com auxílio de pinça hemostátática de Halsted para remoção da cortical interna realizou-se a exposição do segmento medular. O trauma mecânico foi causado por queda da haste de impacto a 12,5 mm de altura, caracterizando uma lesão moderada segundo Santos et al. (2011) (figura 1).
O dispositivo é conectado ao computador no Software Impactor 7.0, que exibe as curvas de trajetória de impacto, apontando possíveis erros de velocidade, tempo e altura de queda. Para o presente estudo foram aceitos animais com erro máximo de 5% durante a indução do trauma.
Após a cirurgia, todos os animais receberam solução fisiológica, na taxa de manutenção (15 mL/kg), via subcutânea (SC). Os animais foram mantidos em caixas aquecidas por meio de cobertores e colchão térmico, com oxigenoterapia até completa recuperação anestésica.
Tratamentos
A aplicação intratecal foi realizada de acordo com o método previamente descrito para ratos por Mestre et al. (1994). Após o procedimento cirúrgico, os animais do grupo CN e CP (após laminectomia) receberam 10 µL de PBS por via intratecal com seringa de Hamilton. Os animais dos grupos MVIIC 15-5 (15 pmol/5min), MVIIC 15-60 (15 pmol/60min), MVIIC 30-5 (30 pmol/5min) e MVIIC 30-60 (30 pmol/60min).
Figura 1. Fotografias do procedimento cirúrgico de trauma medular experimental em ratos Wistar. A) Indução anestésica com isoflurano. B) Animal posicionado em decúbito esternal sobre mesa aquecida com bolsa térmica. Realização de antissepsia com iodopovidona degermante em região dorsal do tronco tricotomizada. Manutenção anestésica por meio de máscara com isoflurano em sistema semiaberto. C) Afastamento da musculatura epaxial e identificação dos processos espinhosos. D) Ostectomia do processo espinhoso com pinça de Halsted. E) Desgaste da lâmina dorsal com drill pneumático. F) Visualização da medula espinhal após laminectomia dorsal. G) Utilização do sistema de estabilização vertebral “clamping system”.
Avaliação dos efeitos colaterais
A ω-conotoxina MVIIC foi avaliada a partir da análise de parâmetros sistêmicos como perfil hematológico, bioquímico e urinálise. Para a realização das avaliações sanguíneas foram coletados 3,0 mL de sangue no dia da eutanásia, por cardiopunção. Metade desse volume foi acondicionada em frasco com EDTA e o restante em tubo sem EDTA. No perfil bioquímico, para avaliação da função hepática, foram dosadas fosfatase alcalina (FA), aspartato aminotransferase (AST) e alanina aminotransferase (ALT). Todas as avaliações de toxicidade foram realizadas no Laboratório de Análises Clínicas da Escola de Veterinária da UFMG. A avaliação dos efeitos colaterais da aplicação da ω-conotoxina MVIIC foi feita através da observação.
Avaliação da capacidade motora em campo aberto
Todos os animais foram adaptados em um campo aberto de um metro de diâmetro e 20 cm de altura, para reduzir o estresse da manipulação e facilitar as avaliações pós-operatórias. A avaliação neurológica foi realizada 24 e 48 horas após o trauma, esta última imediatamente antes de cada eutanásia. Todos os animais foram observados e filmados durante quatro minutos e, posteriormente os vídeos foram assistidos por dois avaliadores sem conhecimento do grupo a que os animais pertenciam. De acordo com a escala proposta por Basso, Beatie e Bresnahan (Basso et al., 1995).
Eutanásia e coleta de materiais
Após quarenta e oito horas do procedimento cirúrgica, os animais foram eutanasiados com 2 ml de lidocaína e sobredose de tiopental sódico (100 mg/kg). Foi feita a dissecação da coluna espinhal, para coleta de dois segmentos medulares: o primeiro, de 1,5 cm, o qual foi dividido em dois fragmentos de 0,75 cm cada um caudal ao epicentro da lesão, acondicionado em tubos plásticos siliconizados e congelados em nitrogênio líquido e mantidos no freezer a –80°C até o processamento para análises de quantificação de EROs e avaliação de peroxidação lipídica, e o segundo, de 1,5 cm, o qual também foi divido em dois fragmentos de 0,75 cada um, foi acondicionado em tubos plásticos siliconizados livres de RNAse/ DNAse e imediatamente congelado a –80°C para avaliação de expressão gênica de fatores relacionados à apoptose por qRT-PCR em tempo real.
Avaliação das espécies reativas de oxigênio
A quantificação das espécias reativas de oxigênio (EROs) foi realizada através da técnica de diclorofluorescéina-diacetato (DCHF-DA). Este método experimental de análise baseia-se na desacetilação da sonda DCHF-DA e sua oxidação subsequente por EROs, gerando um composto altamente fluorescente que é considerado indicador da produção de peróxido pelos componentes celulares (Jakubowski e Bartosz, 2000).
Peroxidação lipídica por método TBARS
A lipoperoxidação foi determinada pela quantificação do conteúdo de malondialdeído (MDA) presente no sobrenadante do homogenato, por meio da reação colorimétrica com ácido tiobarbitúrico (TBARS) em altas temperaturas. Este método consiste na reação de duas moléculas de ácido tiobarbitúrico com uma de malondialdeído, produzindo um complexo de coloração rósea que é quantificado no espectrofotômetro a 535 nm. Para determinação da peroxidação lipídica por método TBARS.
PCR em tempo real
Para avaliação da apoptose realizou-se a técnica de reação em cadeia polimerase qRT-PCR em tempo real para os genes pró-apoptóticos e anti-apoptóticos. Foram utilizados os primeiros das proteínas relacionadas a apoptose Bax, caspase-8, caspase-9 (pró-apoptóticas), Bcl-xl, (antiapoptótica), e da proteína constitutiva beta-actina, utilizada como normalizadora (“housekeeping gene”). Para extração do RNA adicionou-se, a cada amostra, 1 mL do reagente Trizol, foi homogeneizada no aparelho Tissue Lyser II. A síntese do DNA complementar, foi feita pela solução “mix” contendo, para cada amostra, 10μL de 2xRT Reaction e 2,0 μL da enzima RT (transcriptase reversa).
Análise estatística
Todas as análises foram feitas considerando intervalo de confiança 95%, utilizando ambiente R (1). Para a escolha do teste adequado para a comparação dos grupos, foi verificado o perfil de distribuição das variáveis continuas utilizando o teste de Shapiro-Wilk. Para expressão gênica foi assumida distribuição não-paramétrica o teste de comparações múltiplas, teste de Dunn foi aplicado quando o teste de Kruskal-Wallis apresentou p<0,05.
Resultados e Discussão
Avaliação da capacidade motora em campo aberto
A avaliação da capacidade motora, baseada na observação da deambulação espontânea em campo aberto, possibilitou a graduação dos déficits neurológicos, que variaram desde perda da propriocepção à paresia ambulatorial, segundo Basso, Beattie e Bresnaham (1995). Esse teste, embora subjetivo, mostrou-se uma ferramenta de fácil aplicabilidade, acessível, não invasiva e imediata para avaliação tanto da gravidade da lesão como da recuperação motora.
Antes da cirurgia, todos os animais apresentaram parâmetros neurológicos dentro da normalidade, com escore máximo de 21 pontos pela escala BBB (Basso et al., 1996), que foi importante para garantir ausência de déficits anteriores.
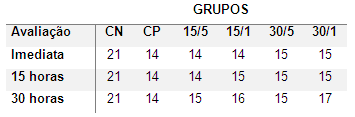
Neste estudo, objetivou-se causar uma lesão de intensidade leve a moderada. Os animais submetidos ao trauma medular apresentaram, imediatamente após indução da lesão, redução de função motora nos membros pélvicos, classificados em escores que variaram de 12 a 17 pontos (Tabela 1). Ausência de déficits neurológicos nos animais pertencentes ao grupo CN, submetidos apenas ao procedimento cirúrgico, indicou que a laminectomia, conforme esperado, não gerou lesão importante ao tecido medular como relatado por Scheff et al. (2003), Ghazemlou et al. (2005), Torres et al. (2010) e Rajão 2014.
Tabela 1. Valores médios de escores de deambulação por escala de Basso, Beattie e Bresnahan (BBB) de ratos submetidos à trauma medular agudo contusivo, avaliados 15 horas e 30 horas após indução do trauma medular. Os animais apresentaram escore máximo de 21 pontos antes da cirurgia.
Fonte: Elaborado pelo autor.
Nas avaliações seguintes, os animais do grupo CN que foram submetidos apenas a laminectomia mantiveram seus escores máximos (21), os animais que sofreram trauma medular não apresentaram diferença estatística comparados com os grupos control, mas no momento da avaliação segundo a escala BBB todos os grupos tratados apresentaram uma melhora na sua resposta motora se comparar com o score inicial, sendo uma resposta bem discreta nas avaliações subsequentes à intervenção cirúrgica A avaliação foi realizada com o objetivo de garantir a não indução de lesão nos animais submetidos a laminectomia e a indução de um trauma leve a moderado nos demais animais do projeto.
Avaliação clínica e laboratorial dos efeitos colaterais da MVIIC
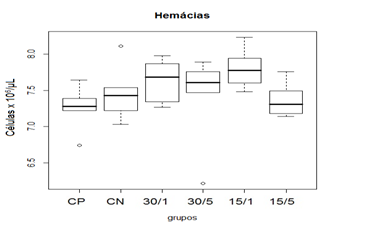
Não foi observada qualquer alteração clínica sugestiva de efeitos colaterais advindos do emprego da ômega-conotoxina MVIIC. Os efeitos colaterais foram avaliados através de observação de sinais clínicos de toxicidade e análises laboratoriais. (Faro et al., 2008; Rajão, 2016; e Milani, 2016). Os valores encontrados nas avaliações hematológicas (quantidade de hemácias, concentração de hemoglobina, quantidade de leucócitos totais) não apresentaram diferença em relação aos padrões fisiológicos para a espécie (Rajão, 2016). Mas, na comparação de medianas entre os grupos tratados, houve diferença estatística na concentração de hemoglobina. Na comparação das medianas, apesar da estatística sugerir diferença entre os grupos, p=0,0464 (Kruskal-Wallis), essa diferença não ocorreu em relação ao grupo CP. Já em relação aos valores de leucócitos totais houve diferença estatística do grupo 15/1 em relação ao CP (p= 0,0294), porém mesmo demostrando essa diferença, os resultados permaneceram dentro dos parâmetros fisiológicos para a espécie.
Figura 2. Representação gráfica de médianas dos valores de hemácias de ratos Wistar submetidos à laminectomia dorsal.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; Animais do grupo tratado (15/5), N= 4, receberam 15pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
Os valores plasmáticos de ALT e AST e de ureia e creatinina não apresentaram diferença estatística, permanecendo dentro dos padrões fisiológicos entre os grupos experimentais (Giknis e Clifford, 2008; Rajão, 2016),
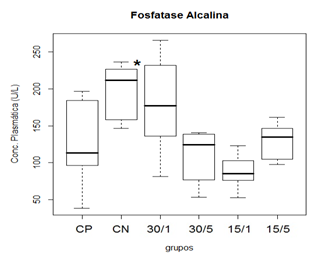
Na análise de FA plasmática, os grupo que foram submetidos a trauma apresentaram diferencia estatística, também se apresento diferencia estatística entre o grupo CP para o CN com um P=0,01989, já para os grupos tratados no houve diferença estatística com o grupo CP, embora exista essa diferencia entre as medianas para o grupo CN e CP não pode se concluir que seja uma colestase ou uma alteração por lesão muscular, já que mesmos apresentada essa diferença de medianas os valores encontram-se dentro dos parâmetros fisiológicos (Thrall, 2007).
Não apresentou alteração na função renal que pode se evidenciar nos níveis séricos normais de ureia e creatinina entre os tempos e as doses aplicadas nos diferentes grupos, estes resultados são indicativos que a toxina nessa concentração não causa alteração sistêmica (Oliveira, 2014).
Figura 3. Representação gráfica de médianas dos valores plasmáticos de FA.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. O grupo CN apresentou mediana maior em comparação ao grupo CP, p=0,01989.
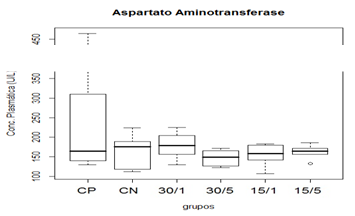
Figura 4. Representação gráfica de médianas dos valores plasmáticos de AST.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30pmol de ω-conotoxin MVIIC após 5 min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
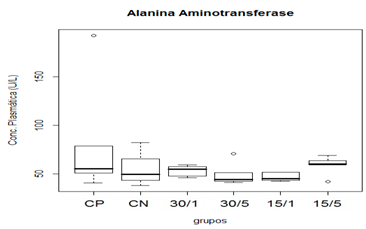
Figura 5. Representação gráfica de médianas dos valores plasmáticos de ALT.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
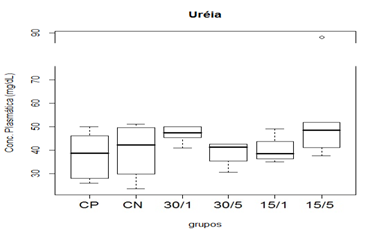
Figura 6. Representação gráfica de médianas dos valores plasmáticos de ureia.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
Efeito da MVIIC sobre expressão gênica de fatores relacionados à apoptose após lesão medular
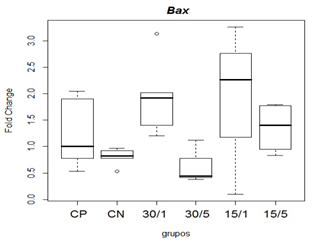
Avaliou-se os efeitos da toxina MVIIC na expressão gênica de fatores relacionados à apoptose (Bax, Bcl-xl, Caspase -8 e -9) por qRT-PCR, após indução de lesão medular contusiva experimental em ratos. Os resultados foram expressos por meio de expressão gênica relativa, através de transformação fold change dada por 2-ΔΔCT. Referente a expressão de Bax, na comparação das medianas não observou-se diferença estatística entre os grupos controles e os grupos tratados 15/5, 15/1, 30/5 e 30/1 na avaliação de 48 horas após lesão medular (figura 7).
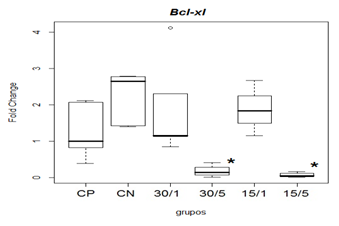
Na avaliação da expressão de Bcl-Xl, os outros grupos tratados 30/5 e 15/5 apresentaram diferença estatística em relação ao grupo CN na comparação das medianas (p<0,05) o que pode ser sugestivo de aumento na expressão de fatores antiapoptóticos nesses tratamentos o que vai favorecer a neuroproteção (figura 8).
Figura 7. Representação gráfica de médianas do fold change (2-ΔΔCT) referentes à expressão gênica dos fatores relacionados á apoptose Bax.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5 min. Animais do grupo tratado (15/1), N= 3, receberam 15pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. Na comparação das medianas não observou-se diferença estatística, p= 0,1067 (Kruskal-Wallis).
Figura 8. Representação gráfica de médianas e desvios-padrão do fold change (2-ΔΔCT) referentes à expressão gênica dos fatores relacionados á apoptose Bcl-xl.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo Controle Negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. O teste de Kruskal-Wallis apresentou p<0,001. Na comparação das medianas, os grupos 30/5 e 15/5 apresentaram diferença estatística em relação ao grupo CN, p<0,05.
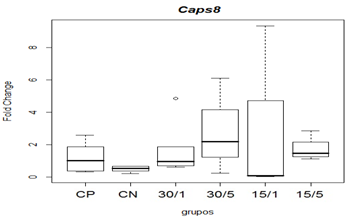
Em relação à expressão de caspase-8, não observou-se diferença estatística na comparação das medianas (figura 9).
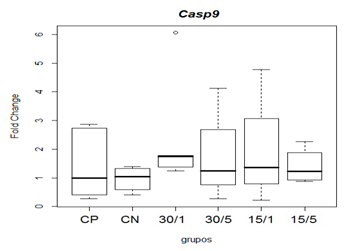
Referente à expressão da caspase -9, não observou-se diferença estatística na comparação das medianas entre os grupos. Montazeri et al. (2013) relatam que, a expressão e ativação da cassasse-9 podem apresentar picos em 6, 24, 48 e 72 horas, podendo persistir por cinco dias, o que não foi observado no presente estudo (figura 10).
Os achados do presente estudo indicam que, seria interessante testar outros genes e reavaliar a utilização da beta-actina como gene controle, uma vez que ele apresenta altamente expresso nos processos inflamatórios, o que vai levar a um deslocamento da curva para esquerda, o que pode sugerir que não há diferença estatística entre os grupos.
Figura 9. Representação gráfica de medianas e desvios-padrão do fold change (2-ΔΔCT) referentes à expressão gênica dos fatores relacionados á apoptose Caspase-8.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5 mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1 h; animais do grupo tratado (30/1), N= 4, receberam 30pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. Na comparação das medianas não observou-se diferença estatística, p=0,3361 (Kruskal-Wallis).
Figura 10. Representação gráfica de medianas e desvios-padrão do fold change (2-ΔΔCT) referentes à expressão gênica dos fatores relacionados á apoptose Caspase-9.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30p mol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5 min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. Na comparação das medianas não observou-se diferença estatística, p=0,6879 (Kruskal-Wallis).
Efeito da ômega-conotoxina MVIIC sobre níveis de ERO após lesão medular
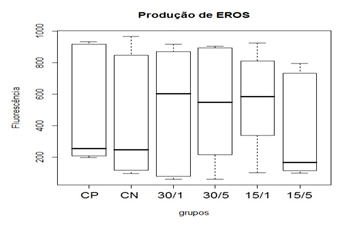
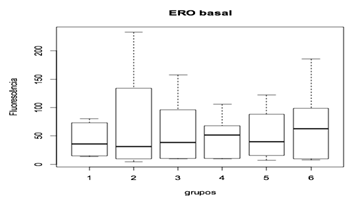
Na produção de ERO’s e seu nível basal, a utilização da ômega-conotoxina MVIIC não apresentou diferença estatística entre as medianas dos grupos (figura 11 e figura 12). A utilização de 15 pmol aos 5 minutos após o trauma da toxina apresentou tendência de redução dos níveis de ERO's em comparação aos grupos controles (CP e CN), o que, provavelmente, estaria relacionado à redução dos eventos patogênicos devido ao acúmulo intracelular de cálcio pelo bloqueio de CCVD.
Observou-se também uma tendência a aumentar os níveis de ERO’s nos grupos tratados com 15 pmol/1 hora, 30 pmol/5 minutos e 30 pmol/1 hora, o que pode sugerir que a toxina nessa dosagem e nesses tempos tenha uma tendência de bloqueio excessivo dos canais de cálcio, podendo levar a alterações metabólicas nas células do tecido neuronal que não foram lesadas no trauma inicial. Porem, apesar de ter demonstrado tendência à redução dos níveis medulares com a aplicação 15 pmol da toxina aos 5 minutos após o trauma e um aumento nos demais grupos tratados, não foi observada diferença estatística.
Figura 11. Efeito da toxina MVIIC sobre a produção de espécies reativas de oxigênio (ERO) 48 horas após trauma medular.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5min. Animais do grupo tratado (15/1), N= 3, receberam 15pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (15/5), N= 4, receberam 15pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
Figura 12. Concentração basal da toxina MVIIC sobre a produção de espécies reativas de oxigênio (ERO) 48 horas após trauma medular.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5 mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo controle positivo (CP), N= 5, receberam PBS intratecal após 1h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5 min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1 h; snimais do grupo tratado (15/5), N= 4, receberam 15 pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
Efeito da ômega-conotoxina MVIIC sobre peroxidação lipídica 48 horas após lesão medular
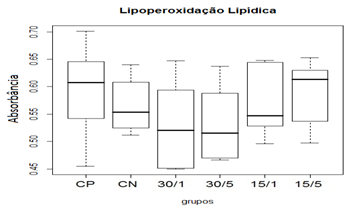
A etapa crítica da produção excessiva de radicais livres é a interação desses compostos com as macromoléculas biológicas como: lipídeos (principalmente dos de membrana), proteínas e DNA. A lipoperoxidação é a degradação oxidativa de um lipídeo, que se inicia quando um radical livre doa um elétron para um ácido graxo de membrana, principalmente insaturado, iniciando uma reação em cadeia que culmina em dano celular (Mylonas et al., 1999).
Levando em conta o anterior, pode-se concluir que a lesão medular primária contusiva foi capaz de induzir estresse oxidativo secundário de maneira eficiente. Além disso, o emprego da toxina MVIIC nos diferentes grupos tratados não apresentou diferença estatística em relação aos grupos controles (CP e CN), não foi capaz de reduzir a peroxidação lipídica 48 horas após indução da lesão e, portanto, não teve participação do sistema anti-oxidante.
Figura 13. Efeito da toxina MVIIC sobre a produção de peroxidação lipídica 48 horas após trauma medular.
Animais foram submetidos a trauma medular com Mascis Impactor (10g/12,5mm) na região tóroco-lombar, T11 (exceto grupo CN). Animais do grupo Controle Positivo (CP), N= 5, receberam PBS intratecal após 1 h do trauma; animais do grupo controle negativo (CN), N= 5, receberam PBS intratecal após 1h; animais do grupo tratado (30/1), N= 4, receberam 30 pmol de ω-conotoxin MVIIC após 1h; animais do grupo tratado (30/5), N=4, receberam 30 pmol de ω-conotoxin MVIIC após 5 min. Animais do grupo tratado (15/1), N= 3, receberam 15 pmol de ω-conotoxin MVIIC após 1 h; animais do grupo tratado (15/5), N= 4, receberam 15pmol de ω-conotoxin MVIIC após 5 min. A estatística de teste não sugeriu diferença entre as medianas (Kruskal-Wallis).
Conclusões
O aparelho estereotáxico indutor de trauma à medula Mascis Impactor é capaz de reproduzir trauma leve a moderado de forma padronizada, o que é de extrema importância no estudo de neuroproteção já que permite gerar um trauma medular agudo, que permitiu a utilização da ômega-conotoxina MVIIC nas doses de 15 e 30 pmol nos tempos de 5 minutos e 1 hora após do trauma para avaliação de neurproteção permitindo concluir que a dose de 15 pmol/5 minutos, após o trauma, não demostrou diferença estatística na produção de radicais livres e nas reações de peroxidação lipídica. Contudo, ela apresentou uma tendência à redução desses níveis; porem o emprego de 15 pmol/1 hora após do trauma embora não tenha apresentado diferença estatística, ele mostrou uma mediana maior aos demais grupos tratados, o que pode sugerir que nessa concentração de toxina tem uma maior expressão de genes pro-apoptotico Bax.
Referências bibliográficas
Ackery, A.; Tator, C.; Krassioukov, A. A Global perspective on Spinal Cord injury Epidemiology. J. Neurotrauma, v. 21, n. 10, p. 1355-1370, 2004.
Aslan, A.; Cemek, M.; Buyukokuroglu, M.E. et al. Dantrolene can reduce secondary damage after spinal cord injury. Eur. Spine J., v. 18, p. 1442-1451, 2009.
Bartholdi, D.; Schwab, M.E. Expression of pro-inflamattory cyitokine and chemokine mRNA upon experimental spinal cord in mouse: an in situ hydridization sutdy. Eur. J. Neurosc., v. 7, p. 1422-1438, 1997.
Basso, D.M.; Beattie, M.S.; Bresnaham , J.C.A. sensitive and reliable locomotor rating scale for open field testing in rats. J. Neurotrauma, v. 1, p. 1-21, 1995.
Basso, M.; Beattie, M.S.; Bresnahan, J.C. Graded histological and locomotor outcomes after spinal cord contusion the NYU weight-drop device versus transection. Exp. Neurol., v. 139, n. 2, p. 244-256, 1996.
Bingham, J.; Mitsunaga, E.; Bergeron, Z.L. Drugs from slugs – Past, presente and future perspectives of ω-conotoxin research. Chemico-Biological, v. 183, p. 1-18, 2010.
Bo, W.; Xian-Jun, R. Control of demyelination for recovery of spinal cord injury. Chin. J. Traumatol., v. 11, n. 5, p. 306-310, 2008.
Brito, L.M.O.; Chein, M.B.C.; Marinho, S.C.; Duarte, T.B. Avaliação epidemiológicas dos pacientes vítimas de traumatismo raquimedular. Rev. Col. Bras. Cir, v. 38, p. 304-309, 2011.
Brouns, R.; Deyn, P.P. The complexity of neurobiological processes in acute ischemic stroke. Clin. Neurol. Neurosur., v. 11, p. 483-495, 2009.
Coelho, R.M.P. Efeito neuroprotetor da toxina phα1β recombinante no trauma medular agudo em ratos. 2016. 76 f. Dissertação (Mestrado). Universidade Federal de Minas Gerais, programa de pós-graduação em ciência animal, Belo Horizonte. 2016.
Dasari, V.R; Spomar, D.G.; Gondi, C.S.; Sloffer, C.A.; Saving, K.L.; Gujrati, M.; Rao, J.S.; Dinh, D.H. Axonal remyelination by cord blood stem cells after spinal cord injury. J Neurotrauma, v. 24, p. 391-410, 2007.
de Souza, A.H.; Castro Jr C.J.; Rigo, F.K.; De Oliveira, S.M.; Gomez, R.S.; Diniz, D.M. An evaluation of the antinociceptive effects of Phα1β, a neurotoxina from the spider Phoneutria nigriventer, and ω-conotoxin MVIIA, a cone snail Conus magustoxin, in a rat model of inflammatory and neuropathic pain. Cell. Mol. Neurobiol., v. 33, p.58-67, 2013.
Degterev, A.; Boyce, M.; Yuan, J. A decade of caspases. Oncogene, v. 53, p.8543-8567, 2003.
Diniz, D.M.; De Souza, A.H.; Pereira, E.M.R.; Da Silva, J.F.; Rigo, F.K.; Romano'silva, M.A.; Binda, N.; Castro, C.J.; Cordeiro, M.N. ; Ferreira, J.; Gomez, M.V. Effects of the calcium channel blockers Phα1β and ωconotoxin MVIIA on capsaicin and acetic acid-induced visceral nociception in mice. Pharmacology, Biochemistry and Behavior, v. 126, p. 97-102, 2014.
Diniz, D.M. Ação farmacológica da toxina Phα1β isolada do veneno da aranha Phoneutria nigriventer em modelos de dor visceral em camundongos. 2012. Dissertação (pós-graduação em Medicina e Biomedicina). Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, Belo Horizonte.
Drummond, B.L. Subfração PnTx 3-6 do veneno da aranha armadeira (Phoneutria nigrivebter) no tratamento de ratos wistar submetidos ao trauma agudo compressivo à medula espinhal. 2010. 52p. Dissertação (Mestrado em Ciência Animal) – Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte.
Estrada, G.; Villegas, E.; Corzo, G. Spider venoms: a rich source of acylpolyamines and peptides as a new lead to CNS drugs. Nat. Prod. Rep., v. 24, p.145- 161, 2007.
Fighera, R.A.; Silva, M.C.; Souza, T.M. et al. Aspectos patológicos de 155 casos fatais de cães atropelados por veículos automotivos. Ciência Rural, v. 38, p. 1375-1380, 2008.
Gomez M.V.; Kalapothakis, E.; Guatimosim, C.; Prado, M.A. Phoneutria nigriventer venom: a cocktail of toxins that affect ion channels. Cell Mol Neurobiol, v. 22, p.579-588, 2002.
Gonçaves J.M.; Ferreira, J.; Prado, M.A.; Cordeiro, M.N.; Richardson, M.; Pinheiro, C.A.N.; Silva, M.A.R.; Castro Junior, C.J.; Souza, A.H.; Gomez, M.V. The effect of spider toxin PhTx3-4, ω-conotoxins MVIIA and MVIIC on glutamate uptake and on capsaicin-induced glutamate release and [Ca2+] in spinal cord synaptosomes. Cell Mol Neurobiol, v. 31, p. 277-283, 2011.
Gross, A.; Mcdonell, J.M.; Korsmeyer, J. BCL-2 family members and the mitochondria in apoptosis. Genes Dev., v.13, p.1899-1911, 1999.
Hagg, T.; Oudega, M. Degenerative and spontaneous regenerative processes after spinal cord injury. J.Neurotrauma, v.23, p.263-280, 2006.
Hillyard, D.R.; Monje, V.D.; Mintz, I.M. et al. A new Conus peptide ligand for mammalian presynaptic Ca2+ channels. Neuron, v. 9, p. 69-77, 1992.
Imaizumi, T.; Kocsis, J.D.; Waxman, S.G. The role of voltage-gated Ca++ channels in anoxic injury of spinal cord matter. Brain Res., v. 817, p. 84-92, 1999.
Jia, X.; Kowalski, R.G.; Sciubba, D.M. et al. Critical Care of Traumatic Spinal Cord Injury. J. Intensiv. Care Med., v. 28, p. 12-23, 2013.
Karalija, A.; Novikova, L.N.; Kingham, P.J. et al. The effects of n-acetyl-cysteine and acetyl-l-carnitine on neural survival, neuroinflammation and regeneration following spinal cord injury. Neuroscience, v. 260, p. 143-151, 2014.
Kawaguchi, M.; Furuya, H.; Patel, P. Neuroprotective effects of anesthetic agents. J. Anesth., v. 19, p. 150156, 2005.
Kim, Y.; Park, Y.K.; Cho, H. et al. Long-term changes in expressions of spinal glutamate transporters after spinal cord injury. Brain Res., v. 1389, p. 194-199, 2011.
Lanz, O.; Bergman, R.; Shell, L. Initial assessment of patients with spinal cord trauma. Vet. Med., p. 851-854, 2000.
Liu, D.; Liu, J.; Wen, J. Elevation of hydrogen peroxide after spinal cord injury detected by using the fenton reaction. Free Radical Bio. Med., v. 27, p. 478-482, 2011.
Liu, Z.-Q.; Xing, S.-S.; Zhang, W. Neuroprotective effect of curcumin on spinal cord in rabbit model with ischemia/reperfusion. J. Spinal Cord Med., v. 36, p. 147-152, 2016.
Martins, B.C. Efeitos da associação do riluzol ao dantrolene em ratos submetidos ao trauma medular agudo. 2012. 70p. Dissertação (Mestrado em Ciência Animal) – Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte.
McDonough, S.I.; Swartz, K.J.; Mintz, I.M.; Boland, L.M.; Bean, B.P. Inhibition of calcium channels in rat central and peripheral neurons by omega-conotoxin MVIIC. J Neurosci, v. 15, p. 2612-2623, 1996.
Mendes, D.S.; Arias, M.V.B. Traumatismo da medula espinhal em cães e gatos: estudo prospectivo de 57 casos. Pesq. Vet. Bras., v. 32, p. 1304-13012, 2012.
Metz, G.A.; Merkler, D.; Dietz, V.; Schwab, M.E.; Fouad, K. Efficient testing of motor function in spinal cord injured rats. Brain Res, v. 883, p. 165-177, 2000.
Minami, K.; Raymond, C.; Martin-Moutot, N. Role of Thr in the binding of omega-conotoxing MVIIC to N-type Ca channels. FEBS Let., v. 491, p. 127-130, 2001.
Oliveira, K.M. Efeitos de diferentes doses de ω–conotoxina MVIIC no tratamento de ratos submetidos ao trauma medular agudo compressivo. 2012. 61 p. Dissertação (Mestrado em Medicina e Cirurgia Veterinárias) – Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte.
Oliveira, K.M.; Lavor, M.S.L.; Silva, C.M.O. et al. Omega-conotoxin MVIIC attenuates neuronal apoptosis in vitro and improves significant recovery after spinal cord injury in vivo in rats. Int. J. Clin. Exp. Pathol., v. 7, p. 3524-3536, 2014.
Oyinbo, C.A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp, v.71, p.281-299, 2011.
Portt, L.; Norman, G.; Clapp, C. et al. Anti-apoptosis and cell survival: a review. Biochim. Biophys. Acta, v. 1813, p. 238-259, 2011.
Santos, G.B.; Cristante, A.F.; Marcon, R.M.; Souza, F.I.; Barros Filho, T. E.P.; Damasceno, M.L. Modelo experimental de lesão medular e protocolo de avaliação motora em ratos wistar. Acta ortop. Bras,. v. 19, n.2, 2011.
Souza, A.H.; Lima, M.C.; Drewes, C.C. et al. Antiallodynic effect and side effects of Pha1b, a neurotoxin from the spider Phoneutria nigriventer: Comparison with ωconotoxin MVIIA and morphine. Toxicon, v. 58, p. 626-633, 2011.
Springer, J.E.; Azbill, R.D.; Kennedy, S.E. et al. Rapid calpain I activation and cytoskeletal protein degradation following traumatic spinal cord injury: attenuation with riluzole pretreatment. J Neurochemistry, v.69, p. 1592-1600, 1997.
Springer, J.E.; Azbill, R.D.; Kennedy, S.E. et al. Rapid calpain I activation and cytoskeletal protein degradation following traumatic spinal cord injury: attenuation with riluzole pretreatment. J Neurochemistry, v.69, p. 1592-1600, 1997.
Torres, B.; Serakide, R.; Caldeira, F. et al. The ameliorating effect of dantrolene on the morphology of urinary bladder in spinal cord injured rats. Pathol. Res. Pract. v. 207, p. 775-779, 2011.
Torres, B.B.J.; Caldeira, F.M.C.; Gomes, M.G. et al. Effects of dantrolene on apoptosis and immunohistochemical expression of NeuN in the spinal cord after traumatic injury in rats. Int. J. Exp. Path., v. 91, p. 530-536, 2010.
Thrall, M.A. Veterinary hematology and clinical chemistry. Philadelphia: Lippincott Williams & Wilkins, 2004. 518p.
Wu, Y.; Zheng, M.; Wang, S. et al. Spatiotemporal pattern of TRAF3 expression after rat spinal cord injury. J. Mol. Hist., DOI 10.1007/s10735-014-95752, 2014.
Como citar: Gutiérrez, J.S.; Rajão, M.P; Osorio, C.; Rubatino, F.; Marliére, M.; Gonçalves, M. Metaanálisis: Ômega-conotoxina MVIIC no trauma experimental da medula espinhal em ratos. Revista Veterinaria y Zootecnia, v. 13, n. 1, p. 99-122, 2019. DOI: 10.17151/vetzo.2019.13.1.8 http://vetzootec.ucaldas.edu.co/index.php/component/content/article?id=269
Esta obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|