|
Respuesta del sistema inmune de las aves al estímulo con ß-glucanos
ARTÍCULO DE INVESTIGACIÓN
John Jairo Salazar. DMV. MSc¹. Inmunopatología
1 Departamento de Servicio Técnico Monogastricos. Nutritec S.A.S-Levapan Colombia.
This email address is being protected from spambots. You need JavaScript enabled to view it.
Recibido: 30 de agosto de 2018, Aprobado: 27 de diciembre de 2018 y Actualizado: 29 de diciembre de 2018
DOI: 10.17151/vetzo.2019.13.1.6
RESUMEN. Introducción: Debido la reducción de la disponibilidad de antibióticos promotores de crecimiento en las aves, los productores avícolas han buscado aditivos para suplementar el alimento, que estimulen el sistema inmune de sus aves. Algunos ß-glucanos han demostrado mejorar la salud gastrointestinal en pollos cuando estos son desafiadas por bacterias. Objetivo: Realizar una revisón de literatura sobre la biología básica de los ß-glucanos y su uso como inmunomoduladores y promotores de crecimiento en pollos. Resultados y conclusión: Los ß-glucanos incrementan el flujo de células dendríticas, aumentan la capacidad fagocítica de los macrófagos, e incrementan el título de anticuerpos después de la vacunación. Por lo tanto funcionan como un inmunomodulador antiinflamatorio. Estas sustancias pueden proveer herramientas para que los productores traten de reducir o eliminar el uso de antibióticos promotores de crecimiento en avicultura.
Palabras clave: ß-glucanos, inmunomodulador, macrófagos
Response of the immune system of the poultry to the stimulation with ß-glucans
ABSTRACT. Introduction: Due to the reduction in the availability of antibiotic-growth promoters in chickens, poultry producers have sought additives to supplement the food, which stimulate the immune system of their birds. Some ß-glucans have been shown to improve gastrointestinal health in chickens when they are challenged by bacteria. Aim: To review the literature on the basic biology of ß-glucans and their use as immunomodulators and growth promoters in chickens. Results and conclusion: ß-glucans increase the flow of dendritic cells, increase the phagocytic capacity of macrophages, and increase the antibody titer after vaccination. Therefore, they function as an anti-inflammatory immunomodulator drug. These substances can provide tools for producers to try to reduce or eliminate the use of poultry growth-promoting antibiotics.
Key words:β-Glucans, immunomodulator, macrophages
Introducción
Las infecciones bacterianas de las aves son extremadamente importantes en lo que concierne a dos factores, el primero se refiere al deterioro de la salud gastrointestinal y el segundo se refiere a cómo se afecta la productividad de las aves debido a la pérdida de la integridad intestinal, el punto radica en la importancia de la transmisión de infecciones vía alimento, como es el caso de las Salmonella spp y los Campylobacter spp., por citar solo estos dos casos. El uso sub-terapéutico de antibióticos promotores de crecimiento ha reducido el impacto sobre las infecciones bacterianas, y ha llevado a la industria avícola mundial a generar resistencias bacterianas (Anwar et al., 2017). La EFSA y CDC (2012) reportaron porcentajes de resistencia de las tetraciclinas, ciprofloxacina y ácido nalidíxico superiores al 35% a las Salmonella spp., y para Campilobacter jejuni, los porcentajes de resistencia reportados para tetraciclinas fue 60% y ciprofloxacina 58%, por lo tanto la consecuencia ha sido el retiro de varios antibióticos promotores de crecimiento (APC) (EFSA and CDC, 2012). Los productores avícolas están trabajando varias alternativas para reducir el uso de antimicrobianos que se deben usar para tratamientos en casos de disbacteriosis.
Se ha presentado un fuerte interés en los “aditivos naturales” que estimulen el sistema inmune de las aves, definidos como inmunomoduladores, se han realizado investigaciones que demuestran que los beta-glucanos (ß-glucanos), juegan un papel en la sustitución de los antibióticos y en el estímulo del sistema inmune. Rathgeber et al. (2008) reporta que el uso de los ß-glucanos provenientes de la pared de la levadura fueron efectivos como promotores de crecimiento en los pollos, comparados con la virginiamicina, un antibiótico usado en los pollos a dosis sub terapéuticas. Igualmente, Zhang et al. (2008) reporta que la suplementación de las dietas en pollos de engorde con ß-glucanos puede mejorar el peso de ganancia diaria promedio y la conversión alimenticia.
El efecto inmunomodulador de los ß-glucanos en los mamíferos está bien documentado, aunque el sistema inmune de los mamíferos y las aves son similares no es posible extrapolar esas investigaciones de mamíferos a las aves, por lo tanto el objetivo de esta revisión es determinar si los ß-glucanos mejoran la respuesta inmune de las aves, incrementado la expresión de IgA, disminuyendo la agresión por bacterias y mejorando los parámetros productivos (Anwar et al., 2017).
Glucanos (ß- glucanos)
Los ß-glucanos son polímeros de glucosa muy complejos, que estructuralmente hacen parte de las paredes celulares de muchos organismos, están en las bacterias, levaduras, hongos y algas. Se encuentran en la avena y la cebada, están conformados por seis anillos de glucosa, unidos en forma lineal, con enlaces glicosídicos (Jacob & Pescatore, 2014). La naturaleza de estos enlaces glicosídicos puede alterar la funcionalidad de las moléculas. Los β-glucanos tienen una estructura de moléculas de glucosa a la cual se le vinculan en la región 1→ 3, los átomos de carbono. Los β-glucanos provenientes de paredes bacterianas son estructuras simples de glucosa, los provenientes de levaduras tienen una cadena 1→3 y1→6 donde se unen los átomos de carbono. La estructura de los glucanos provenientes de los hongos, tiene un lado más corto que la proveniente de las levaduras, y los glucanos provenientes de la cebada tienen los átomos de carbono unidos en la posición 1→4, y algunos en la posición 1→ 3. Las uniones 1→3 le confieren una naturaleza semi-flexible de los átomos de carbono, a diferencia de la posición 1→4 que le da la forma de pliegue.
Figura 1. Estructura molecular de los β-glucanos (1→3)(1→6) de la pared de lavadura. Tomado de Jacob y Pescatore (2014).
Tabla 1. Tipos de uniones de los átomos de carbono en los β-glucanos, de diferentes orígenes. Adaptado de Jacob y Pescatore (2014).
Inmunidad innata e inmunidad adaptativa en las aves
En las aves existe una clara demarcación en la producción de linfocitos, existe una clara demarcación en la producción entre los linfocitos B y linfocitos T desde la formación del embrión, cada población de estas células se origina en órganos linfoides especializados. Los linfocitos T se desarrollan en el timo y los linfocitos B en la bolsa de Fabricio (Fellah et al., 2008).
Las aves tienen la capacidad de reconocer lo propio de lo extraño, en lo que se refiere a sus células, este hecho se debe a que en su superficie tienen marcadores de reconocimiento denominado el complejo mayor de histocompatibilidad (MCH). Para iniciar una respuesta inmune adquirida, las moléculas antigénicas deben fraccionarse en el interior de las células, los fragmentos generados deben unirse a receptores apropiados para la presentación de antígenos (Tizard, 2009). Los receptores que presentan antígenos se denominan “moléculas de histocompatibilidad” son glucoproteínas codificadas por genes localizados en un clúster génico denominado “complejo mayor de histocompatibilidad”, estos fragmentos antigénicos pueden iniciar una respuesta solo cuando están unidos a el CMH que a su vez son reconocidos por los receptores antigénicos de los linfocitos (Tizard, 2009).
Las células que tienen relación con la inmunidad celular son los linfocitos T, los cuales están asociados al timo, después de que las células extrañas son degradadas, los macrófagos presentan péptidos bacterianos o determinantes antigénicos de las células T y B (Qureshi, 2003; Genovese et al., 2013).
Existen diferentes tipos de células T, células T citotóxicas (Tc), que se unen al complejo antígeno-CMH, sobre los macrófagos, estos secretan interleukina-1(IL-1), en respuesta se activan las células T ayudadoras (Th1), unidas a otro complejo antígeno –CMH donde los macrófagos liberan IL-2, que activan los Tc, creando después de varias divisiones una gran población de dichas células, luego estas células se dividen en dos grandes subpoblaciones de células, unas que van al exterior a destruir células infectadas y otras que se convierten en células de memoria; las cuales son retenidas para una futura exposición a ese patógeno. Las células efectoras se pueden unir el cuerpo a células infectadas y secretar perforinas las cuales causan perforaciones en las células infectadas, dentro de las cuales derraman su contenido (Jacob & Pescatore, 2014).
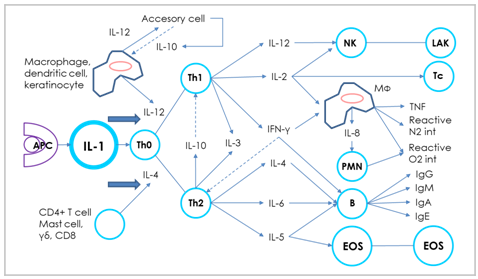
Los macrófagos liberan IL-1ß, interferón gamma (INF-ϒ), IL-2, factor de necrosis tumoral (FNT), y IL-4, la liberación de IL-4, resulta en el desarrollo de las células ayudadoras (Th2), estas estimulan la producción Il-5, IL-6, Il-10, Il-13, las cuales están relacionadas con la respuesta inmune humoral. También pueden producir Il-8 (liberando CXCLI2), es una quinaquina muy importante en la respuesta inmune innata, cuya primera función es inducir las migración de las células al sitio de inflamación (Cox et al., 2010). la IL-8 es una potente quiomiquina proinflamatoria producida por los macrófagos, luego de la exposición a un patógeno, la IL-8 trabaja con la IL-12 para inducir una respuesta inmune mediada por células, y el objetivo primario de las células es secretar INF-ϒ (Cox et al., 2010) (figura 2).
Inmunidad innata e inmunidad adaptativa en las aves
Figura 2. Adaptado de: Rojas et al. (2017). Mucosa del tracto digestivo, Inmunología Rojas v (10): 218.
Los macrófagos representan células de la línea blanca que fagocitan los invasores (Qureshi, 2003), en una respuesta inmune típica los macrófagos reconocen a los patógenos por marcadores específicos que están en su superficie y que se describen como proteínas marcadoras asociadas a microbios (MAMPs, por sus siglas en ingles). Los MAMPs se unen sobre los receptores de las células fagocíticas o receptores Toll-Like (TLRs) (Medzhitov et al., 1997). Las aves poseen 10 TLRs conocidos (Temperley et al., 2008). Los TLRs en las aves son: TLR-2 que reconocen peptidoglicanos, TLR-4 que se unen a los lipopolisacáridos (LPS) de las bacterias gram negativas. TLR-5 que reconocen flagelos. Los TLR-21 que reconocen aminoácidos CpG DNA no metilados, comúnmente hallados en bacterias (Keestra et al., 2010). Cuando un patógeno invade a un hospedero el macrófago se una a este por medio del MAMPs que lo atrae por su receptor TLRs de su superficie, luego lo lleva a su citoplasma formando un fagosoma, Seguidamente, el fagosoma se fusiona con el lisosoma y destruyen el organismo engolfado. La función fagocítica de los macrófagos ha sido demostrada cuando son inmunomodulados con ß-glucanos. La suplementación de la dieta con ß-glucanos provenientes de la levadura Saccharomices cerevisiae ha demostrado un aumento en la actividad fagocítica de los macrófagos (Gou et al., 2003).
Efecto sobre el sistema inmune de las aves suplementadas con β-glucanos
El revestimiento del intestino provee un mecanismo de defensa natural contra la mayoría de los patógenos gastrointestinales, está compuesto de criptas revestidas de vellosidades intestinales, mucus y defensinas que son secretadas por las células Globet (Rojas et al., 2017), en trabajos de investigación. Shao et al. (2013) observó que en aves desafiadas con Salmonella thyphimurium se presentaba una disminución de la altura de las vellosidades entéricas, y un cambio significativo en la relación negativa del radio que hay entre la profundidad de las criptas y las vellosidades, de las aves que no fueron tratadas con ß-glucanos y desafiadas con Salmonella thyphimurium. Anatómicamente, las células Globet son las encargadas de producir y secretar mucus cuya función es servir de primera línea de defensa contra cualquier agresor. En aves desafiadas con Salmonella thyphimurium y suplementadas con ß-glucanos, el número de células Globet aumentó en el yeyuno (Shao et al., 2013). Lo anterior sugiere que los ß-glucanos juegan un papel importante en mejorar el desempeño de la salud gastrointestinal de las aves desafiadas con bacterias.
Todas las células relacionadas con las reacciones inmunes, se originan de un precursor común. Los ß-glucanos estimulan la producción de esos precursores en la medula ósea, dando como resultado un aumento en el flujo de nuevos heterófilos en varios órganos linfoides del cuerpo Este incremento en la protección se da contra potenciales invasores. Lowry et al. (2005) reportó que luego de alimentar pollos de un día de edad, suplementando el alimento con ß-glucanos, disminuyó significativamente los niveles de Salmonella Enteritidis (SE), en el hígado y en el bazo, esta bacteria es un patógeno en humanos. Los ß-glucanos actúan al incrementar la fagocitosis para eliminar las bacterias como consecuencia del aumento de un flujo oxidativo por los heterófilos, esto fue confirmado por Chen et al. (2008), quien reportó que la suplementación con ß-glucanos provenientes de las levaduras mejoran sus defensas contra Salmonella enteritidis, al aumentar la fagocitosis y la actividad bactericida de los macrófagos abdominales.
Los macrófagos producen una enzima denominada iNOS (óxido nítrico sintetasa), esta enzima resulta de la reacción del óxido nítrico con aniones de super óxidos que generan derivados tóxicos (superóxidos), los cuales permiten a los macrófagos eliminar varios tipos de patógenos. Cox et al. (2010) reporta que un aumento del iNOs responde al aumento en la suplementación con ß-glucanos que aumenta la capacidad destructiva de los macrófagos.
La suplementación con ß-glucanos ha mostrado que altera el perfil de citoquinas de las aves no desafiadas de un día de edad (Cox et al., 2010), comparados con pollos no suplementados como controles, las aves que recibieron ß-glucanos provenientes de Saccharomices cerevisiae disminuyeron la expresión de la IL-8, esta suplementación del alimento sugiere que los ß-glucanos tienen una actividad anti-inflamatoria e inmunomoduladora (Cox et al., 2010).
Cox et al. (2010) fue el primero en reportar el efecto de la dieta con ß-glucanos sobre la IL-18, y que la expresión de esta interleuquina proinflamatoria, puede ser regulada en el yeyuno, siete días después de ser consumido el ß-glucano. Para el día 14 disminuye la IL-18 en el duodeno. El INF-ϒ el cual juega un papel importante en la diferenciación de las células Th1 y en la activación de los macrófagos, reporta que se regularon en comparación con los controles, la suplementación con ß-glucanos, 7 días post incubación, aumenta la expresión INF-ϒ y de la IL-4 en el duodeno, yeyuno e íleon, al día 14.
Se ha argumentado que los ß-glucanos agilizan la respuesta del CMH y la subsecuente activación de monocitos y macrófagos (Zhang et al., 2008), dando como resultado un incremento de la respuesta inmune celular, que incluye las células T citotóxicas (Tc), los macrófagos, las natural killers (NK); esto es porque se produce un aumento en la proliferación de IL-1, IL-2, INF-ϒ y FNTα, que actúan regulando la señal de estos componentes del sistema inmune.
Las células tipo B son linfocitos con anticuerpos ligados a su superficie, los anticuerpos reconocen a sus antígenos específicos en este lugar, cuando las células B reconocen un antígeno, pueden suceder dos cosas que priman en los linfocitos B: la primera, que la IL-2 desde las células tipo Tc actúa como un señalizador para crear una gran población de linfocitos B; la segunda, que los linfocitos B se subdividen en dos subpoblaciones de células efectoras de memoria. Las células efectoras están relacionadas con la producción de anticuerpos, las cuales están preparadas para una futura infección por patógenos. Las células efectoras se transportan por vía sanguínea para atacar a los patógenos, los anticuerpos marcan patógenos para su destrucción y dicha destrucción es llevada a cabo por los macrófagos, las NK. Un papel similar juegan las células T citotóxicas (Tc).Los heterófilos son granulocitos fagocitos y su función equivalente es la de los neutrófilos, los gránulos intra-citoplasmáticos de los granulocitos contienen lisozimas y proteínas necesarias para su actividad bactericida, la inclusión de β-glucanos en la dieta provenientes de la levadura Saccharomices cerevisiae, da como resultado un aumento significativo de los títulos por la prueba de Elisa de bloqueo contra la enfermedad de New Castle y bronquitis infecciosa, comparados con los controles no suplementados con ß-Glucanos (An et al., 2008).
El tracto gastrointestinal de las aves es una importante interface entre el medio ambiente externo y la parte interna de su cuerpo, la inmunidad gastrointestinal es la primera línea de defensa contra varios patógenos, en las aves el GAL, o sistema inmune asociado al intestino, que incluye tonsilas cecales y placas de Peyer, son conocidos como lugares de agregados linfocitarios. Las estructuras del GAL inducen una respuesta inmune, incluyendo la producción de inmunoglobulina A (IgA), desde los linfocitos B. La IgA se encuentra en la bilis, en las mucosas (intestino), en las lágrimas, y su función es neutralizar virus y toxinas bacterianas para evitar la colonización bacteriana en las mucosas.
La IgA es una molécula muy importante en la defensa de la mucosa intestinal de las aves, en lotes desafiadas con Salmonella thyphimurium se incrementó el nivel de IgA, estos niveles de inmunoglobulina siempre fueron más altos en aves que recibieron dietas suplementadas con β-glucanos (Shao et al., 2013). Igualmente, se redujeron los niveles de infiltración por Salmonella thyphimurium en el ciego y el hígado.
Muchas de las investigaciones en las aves se han hecho con β-glucanos provenientes de la pared de levadura. Cheng et al. (2004) demostró que el β-glucano 1,3 glucan, proveniente del hongo Schizophylun commune, incrementa significativamente la quimiotaxis de los macrófagos, pero no tiene efecto sobre la blastogénesis de los linfocitos luego de una exposición a mitógenos y no presentó efecto positivo en el título de anticuerpos contra la enfermedad de New Castle luego de una vacunación. La diferencia puede ser por el nivel de β-glucanos usados en la dieta Cheng et al. (2004) a bajos niveles de inclusión.
Los betaglucanos provenientes de los hongos promueven la proliferación de esplenocitos y la IL-2 (Cheng et al., 2008), los β-glucanos purificados del hongo Pleuratus florida provee a los pollos alguna protección contra New Castle. Zhang et al. (2012) suplementó aves con β-glucanos comerciales, los productos derivados de las bacterias Agrobacterium garantizaron que tenía el 86,1% de 1,3 β-glucanos, no se observaron cambios significativos en los perfiles sanguíneos, se incrementó del 3,9% el tamaño del bazo, esto puede de igual manera aumentar la expresión de IL-4.
Un impacto adicional del efecto de los β-glucanos tiene que ver con la respuesta a los micotoxinas, tales como la aflatoxina B1, el consumo continuado de AFB1 que demuestra un deterioro en la salud gastrointestinal, baja la productividad y genera disfunción en el sistema inmune, esto es causado por el daño en el DNA celular (Zimmerman et al., 2014). Los ß-glucanos provenientes de la pared de levadura Saccharomices cerevisiae han demostrado que son citoprotectivos y genoprotectivos de los linfocitos aviares (Zimmerman et al., 2015). Los investigadores especulan que la citoprotección es el resultado del bloqueo de la mutación celular, esto puede ser debido a que los ß-glucanos tienen la capacidad de absorber las aflatoxinas.
Let et al. (2011), reporta que los ß-glucanos pueden potenciar la respuesta inmune a la vacunación contra influenza H5 para las vacunas de influenza con vehículos en aceite.
Conclusiones
Hay diferentes tipos de ß-glucanos, los ß-glucanos provenientes de los cereales, como la avena, tienden a presentar un efecto perjudicial en la salud gastrointestinal de las aves, si se suplementa cebada y avena, para desdoblar el glucano es necesario utilizar enzimas, que digieran el ß-glucano. Otros glucanos provenientes de la pared de levadura, tienden a mostrar beneficios en la salud de las aves, ellos incrementan la respuesta inmune y aumentan la producción de heterófilos y macrófagos, se ha demostrado que se aumenta el efecto de la fagocitosis por los macrófagos, dichos ß-glucanos mejoran la respuesta inmune al alterar el perfil de respuesta de las citoquinas.
Los ß-glucanos además proveen una herramienta para los avicultores que traten de reducir al máximo el uso de los antibióticos en las dietas para aves. El uso de los ß-glucanos se ha demostrado que mejora la protección contra las micotoxinas, puede mejorar la respuesta inmunológica del ave a las vacunas de New Castle, bronquitis infecciosa e influenza aviar.
Referencias bibliográficas
Anwar, M.; Muhammed, F.; Awais, M.; et al. A review of ß-glucans as a grow promoter and antibiotic alternative against enteric pathogens in poultry. Worlds Poultry Science Journal, v. 73, n. 3, p. 651-661, 2017).
Cox, C.M.; Stuard, L.H.; Kim, A.P.; et al. Performance and immune response to dietary ß-Glucans in Broiler Chickens. Poultry Science, v. 89, n.9, p. 124-133, 2010.
EFSA and CDC. 2012
Fellah, S.J.; Jaffredo. T.; Nagy, N. et al. Development of the Avian Immune System. Avian Immunology, Elsevier 3. p. 51, 2008.
Genovese. K.J.; He, H.; Sawaggerty, C.L et al. The Avian Heterophil. Comparative Immunology, v. 41, n. 3, p. 334-340, 2013.
Gou, Y.; Ali, R.A.; Qureshi, M.A. The influence of ß-glucan on immune response in broiler chickens. Immunopharmacol Immunotoxicol, v. 25, n. 3, p. 461-472, 2003.
Jacob, J.P.; Pescatore, J.A. Barley β-glucans in poultry Diets. Annals of Translational Medicine, v.2, n.2, p. 20, 2014.
Keestra, A.M.; de Zoete, M.R.; Bouman, L.I. et al. Chicken TLR 21 is an innate CpG DNA receptor distinct of a mamilian TLR 9. J. Immunol, v 185, n. 1, 460-467, 2010.
Medizhitov, R.; Preston-Hulburt, P.; Jeneway, C.A Jr. A human homologue of the Drosophila Toll Protein Signals activation of immune adaptive response. Nature, v. 388, n. 6640, p. 394-397, 1997.
Qureshi, M.A. Avian macrophage and immune response: an overview. Poultry Science, v. 82, n. 5, p. 691-698, 2003.
Rathgeber, B.M.; Budgell, K.L.; MacIsaac, J.L. et al. Growth performance and spleen and bursa weight of broilers fed yeast betaglucan. Canadian Journal of Animal Science, v. 88, n. 3, p. 469-473, 2008.
Rojas, X et al. Mucosa del tracto digestivo. Inmunología de Rojas, v. 10, p. 218, 2017.
Shao, Y.; Guo Y.; Wang, Z. Β-1, 3/1,6-Glucanalleviated intestinal mucosal barrier impairment of broiler chickens challenged with Salmonella enterica serovar Typhimurium. Poultry Science, v. 92, n. 7, p. 1764-1773, 2013.
Temperley, N.D.; Berlin, I.R.; Patton, D.K.; et al. Evolution of the Chickens toll-Like receptors gene family: A history of the gene gain and gene loss. BMC Genomics, v. 9, p. 62-74, 2008.
Tizard, I.R. El Complejo Mayor de Histocompatibilidad. Introducción a la Inmunología Veterinaria. 8 Ed. Elsevier España. 2009, 101 p.
Zhang, B.Z.; Guo, Y.; Wang, Z. The modulating effect of β-1, 3/1, 6-glucan Supplementation in the diet on performance and immunological responses of broiler chickens. Asian-Aust. J. Anim. Sci., v. 21, n. 2, p. 237-244, 2008.
Como citar: Salazar, J.J. Respuesta del sistema inmune de las aves al estímulo con ß-glucanos. Revista Veterinaria y Zootecnia, v. 13, n. 1, p. 83-92, 2019. DOI: 10.17151/vetzo.2019.13.1.6 http://vetzootec.ucaldas.edu.co/index.php/component/content/article?id=267
Esta obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|