|
Metaanálisis: Efecto inmunomodulador sobre la IgA, generado por los β-glucanos 1,3/1,6 (Sacharomices cerevisiae), en pollos de engorde desafiados con Salmonella entérica
ARTÍCULO DE INVESTIGACIÓN
John Jairo Salazar DMV1
1 Médico Veterinario Servicio técnico Nutritec Levapan región andina 2 Gerente proyectos Nutritec Levapan Latinoamérica 3 Gerente trabajos de campo Nutritec Levapan Colombia 4 Bioestadística aplicada a poblaciones Universidad del Quindío
Recibido: 29 de agosto de 2018, Aprobado: 15 de octubre de 2018 y Actualizado: 29 de diciembre de 2018
DOI: 10.17151/vetzo.2019.13.1.5
Efecto inmunomodulador sobre la IgA, generado por los β-glucanos 1,3/1,6 (Sacharomices cerevisiae), en pollos de engorde, desafiados con Salmonella entérica
RESUMEN. Introducción: Los β-glucanos 1,3/1,6 provenientes de la pared de la levadura Sacharomyces cereviciae son empleados como inmunomoduladores en pollos de engorde pero no existen datos que soporten su uso en avicultura. Objetivo: Hacer un metanailisis de los estudios que evaluan el efecto inmunomodulador de los β- glucanos provenientes de S. cereviciae y su acción sobre la secreción de la inmunoglobulina A (sIgA) en pollos desafiados con Salmonella enteritidis. Métodos: Se realizó un metaanálisis sobre los estudios reportados en las bases de datos: PUB MED, MED LINE y SCIENCE DIRECT, entre los años 2000-2018. Los datos fueron evaluados con el programa QUALITY CONSORT. Resultados: El proceso de revisión sistemática y metaanálisis arrojó 30 estudios, de estos se eliminaron 26 trabajos que no cumplían con los requisitos. Unicamente se analizaron 4 estudios que incluyeron 356 pollos. El ANOVA de la gran media demostró un aumento significativo de la sIgA de pollos tratados con una dosis de 25mg/Kg de β-glucanos en comparación con pollos control. Además, se observó una gran variación en la producción de IgA en dosis que fluctuaban entre 25-100 mg/Kg. Así mismo, al comparar dichas dosis y su efecto con el tiempo de uso, se observó que a los 15 días de uso continuo de los β-glucanos la secreción de sIgA se mantenía estable. Conclusiones: La suplementación en la dieta con β-glucanos 1,3/1,6 puede incrementar la secreción de sIgA cuando se usa una dosis de 25 mg/Kg por un periodo de 21 días en aves desafiadas con Salmonella enteritidis.
Palabras clave: β-glucanos 1,3/1,6, Sacharomices cereviciae, Salmonella, sIgA
Immunomodulatory effect on IgA, generated by β-glucans 1,3 / 1,6 (Sacharomices cerevisiae), in broilers challenged with Salmonella enterica
ABSTRACT. Introduction: The β-glucans 1,3/1,6 from the yeast wall of Sacharomyces cereviciae are used as immunomodulators in broilers but there is no data to support their use in poultry farming. Aim: To perform a meta-analysis of the studies that evaluate the immunomodulatory effect of β-glucans from S. cereviciae and their action on the secretion of immunoglobulin A (sIgA) in chickens challenged with Salmonella enteritidis. Methods: A meta-analysis was conducted on the studies reported in the databases: PUB MED, MED LINE and SCIENCE DIRECT, between 2000-2018. Data were evaluated with the QUALITY CONSORT software. Results: The process of systematic review and meta-analysis yielded 30 studies, of which 26 papers that did not meet the requirements and were eliminated. Only four studies that included 356 chickens were analyzed. The ANOVA of the great mean showed a significant increase in the sIgA of chickens treated with a dose of 25mg/Kg of β-glucans compared to control chickens. In addition, a great variation in the production of IgA was observed in doses ranging between 25-100 mg/kg. Likewise, when comparing these doses and their effect with the time of use, it was observed that after 15 days of continuous use of β-glucans the secretion of sIgA remained stable. Conclusions: Dietary supplementation with β-glucans 1,3/1,6 may increase sIgA secretion when is used at a dose of 25 mg/Kg, for a period of 21 days in broilers challenged with Salmonella enteritidis.
Key words: β- 1,3/1,6 glucans, Sacharomices cereviciae, Salmonella, sIgA
Introducción
El género Salmonella pertenece a la familia de las enterobacteriaceas, presenta características como anaerobias facultativas, gram negativas, pueden ser móviles con flagelos e inmóviles, fermentan glucosa, forman gas y reducen nitratos a nitritos y contempla cerca de 2.700 serovariedades (Grimont et al., 2000).
Todos los serotipos huésped-específico producen una infección sistémica con diferentes signos clínicos, la Salmonella puede causar enfermedad en otras especies y son denominadas cepas adaptadas al hospedador. Un ejemplo del argumento anterior es el caso de la S. typhimurium y S. enteritidis que son los dos serotipos de las aves que con más frecuencia se transmiten a los humanos (Uzzau et al., 2000).
El Centro de Diagnóstico y Control (CDC) en Estados Unidos reporta aproximadamente 1,4 millones de casos de Salmonellas no tifoideas, de estos casos 40.000 son causados por la Salmonella enteritidis (Mead et al., 1999), además la tasa de mortalidad reportada es de 500 muertes por año, la mayoría de los aislamientos son por S. enteritidis (24,7%) y S. typhimurium (23,5%) (Glynn et al., 1998).
La incidencia en Colombia para 2010 es de 1,8 casos por cada 100.000 habitantes (759 casos) (Instituto Nacional de Salud, 2011).
El intestino posee una barrera mecánica formada por células epiteliales (enterocitos) con uniones complejas unidas fuertemente (Claudin y Ococlaudin), estos juegan un papel muy importante en la absorción de nutrientes, electrolitos, agua y le dan al intestino una fortaleza como barrera intestinal que lo mantiene libre de la invasión de patógenos. El daño de las uniones intercelulares no causa trastornos en la permeabilidad únicamente, además permite el paso de antígenos, aumenta la posibilidad de traslocar bacterias dentro del lumen intestinal, lo cual puede conducir a una infección y una endotoxemia, que disminuye la absorción de nutrientes exógenas y endógenas (Tsukita et al., 2001; Catalioto et al., 2011; Ulluwishewa et al., 2011).
La Salmonella enterica puede colonizar e invadir el tracto gastrointestinal, dañando la barrera intercelular, esto puede causar una gastroenteritis aguda y bacteria en las aves y en los humanos (Griffin & McSorley, 2011).
La disminución de la colonización por Salmonella del tubo gastrointestinal y el mantenimiento de la integridad de la barrea intercelular, es primordial, para evitar la contaminación de las carcasas en matadero. Varias actividades profilácticas se han realizado en la industria avícola del pollo para el control de la infección que incluyen: aumento de los niveles de higiene, antibióticos, exclusión competitiva, uso de prebióticos, probióticos, selección genética, aves con mejor respuesta inmune y el desarrollo de vacunas. Aunque los antibióticos son una de las herramientas más efectivas para el control de la salmonelosis, el desarrollo de resistencia bacteriana ha aumentado en los últimos años y ha llevado la industria avícola a restringir su uso, por eso es necesario desarrollar alternativas para enfrentar esos desafíos bacterianos (Vandeplas et al., 2010).
Los β-glucanos son polímeros de glucosa, unidos por enlaces glicosídicos que se encuentran en la pared celular de las bacterias, los hongos, y levaduras, dentro de estas están las de la avena y la cebada (Manners et al., 1973). Los β-glucanos provenientes de la pared de levadura poseen dos ramificaciones comprimidas del pyranosil, denominadas ramificaciones 1,3/1,6 (Soltanian, 2009; Volman et al., 2008). Estas ramificaciones de polímeros difieren en su dirección y estructura interna (Cheung et al., 2002), las sustancias que tienen β-glucanos, como las levaduras, los hongos, los granos y las algas marinas pueden mejorar la respuesta inmune del hospedador frente a infecciones bacterianas. Los β-glucanos de las levaduras (YG), extraídos como polisacáridos de la pared Sacharomices cerevisiae han sido ampliamente estudiados y demuestran que poseen una actividad inmunomoduladora, relacionada con los receptores de reconocimiento similares (TLRs), mejorando la respuesta inmune contra los agentes infecciosos (Lowry et al., 2005). Gou et al. (2003) demuestra que los β-glucanos 1,3/1,6 provenientes de la pared de levadura Sacharomices cerevisiae elevan la capacidad fagocítica de los macrófagos y aumenta la proliferación de linfocitos, de igual manera se incrementa la actividad de los linfocitos CD8 en las aves (Chae et al., 2006); además se ha demostrado que la inclusión en la dieta para pollos de engorde de los β-glucanos 1,3/1,6 aumentó las respuestas inmunes de la mucosa intestinal y redujo las lesiones en el tejido intestinal en aves con desafíos de coccidia (Cox et al., 2010ª); en la última década hay evidencia de que el uso de β 1,3/1,6, incrementó la efectividad en la eliminación de importantes patógenos tales como la Salmonella y Escherichia coli en pollos de engorde (Lowry et al., 2005; Huff et al., 2006) (Imagen 1).
Todos los estudios referenciados anteriormente principalmente se focalizan en la respuesta de los β-glucanos 1,3 /1,6 sobre el sistema inmune de las aves, una de las virtudes de estas sustancias es la secreción de anticuerpos locales al estimular su efecto protectivo en la mucosa intestinal para eliminar bacterias gram negativas como Salmonella enteritidis por lo anterior: el objetivo del presente metaanálisis fue evaluar el efecto de los β-glucanos 1,3/1,6 provenientes de la pared de levadura (Sacharomices cerevisiae) sobre la secreción de IgA (sIgA) en pollos desafiados con Salmonella enteritidis en uso continuo hasta los 21 días de edad.
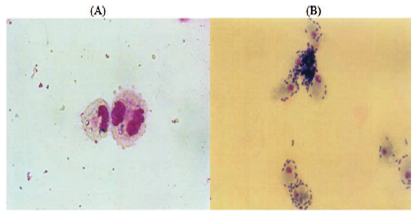
Imagen 1. Morfología de los macrófagos abdominales luego de 24 horas de incubación(A), macrófagos abdominales fagocitando Salmonella enteritidis. Extendido por Lui Stein con una amplificación de 1x1000. Adaptado de Chen et al., 2008.
Materiales y Métodos
Revisión de literatura
Se restringió la búsqueda de los estudios de investigación al efecto inmunomodulador sobre la secreción de IgA de los β-glucanos 1,3 /1,6 (Sacharomyces cerevisiae) en pollos de engorde desafiados con Salmonella enteritidis a la literatura publicada entre 2000 a 2018, se incluyeron todos los estudios escritos en español e inglés, usando las bases de datos computarizadas (PUBMED, MED LINE, SCIENCE DIRECT), todos los estudios fueron revisados para obtener la información requerida por el QUALITY CONSORT, tamaño de la muestra, numero de pollos desafiados con Salmonella enteritidis, número de aves no desafiado (control), dosis usada (mg/k), esquema de dosificación en días.
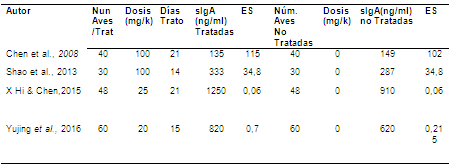
Tabla 1. Variables que proveyeron los estudios seleccionados efecto del uso de los β-glucanos1,3 /1,6 sobre la secreción de IgA en pollos de engorde desafiados con Salmonella enteritidis.
Búsqueda de literatura
La combinación de las palabras claves de la pregunta primaria fueron las siguientes: [(Poultry OR Broiler OR Chiken) AND (Treatment Salmonella enteritidis OR Control Salmonella enteritidis) AND (β-Glucan 1,3/1,6 OR Yeast Cell Wall)], se identificaron 30 referencias bibliográficas con las palabras de búsqueda, no hubo restricción para la inclusión de resúmenes de revistas o artículos o tesis de grado, se tuvieron en cuenta los artículos escritos en inglés y español, en la primera fase de selección fueron eliminados 24 artículos por los siguientes motivos: 17 porque se referían a la respuesta inmune de los β-glucanos como inmunomoduladores de la inmunidad celular o humoral; seis artículos evaluaron el efecto de losβ-glucanos contra la variable ganancia de peso; uno hizo referencia a un estudio en humanos: posteriormente, en el segundo filtro de análisis se eliminaron las dos tesis porque no hacían referencia a la variable secreción de inmunoglobulina A (sIgA), arrojando un total de 4 trabajos para la revisión sistemática y metaanálisis de los β-glucanos 1,3/1,6 como inmunomoduladores sobre la IgA en pollos desafiados con Salmonella enteritidis.
Diagrama de flujo 1. Número de estudios incluidos en cada estado de la selección del proceso.
Tabla 2. Criterio de exclusión (n=26) para el metaanálisis de efecto de los β-glucanos 1,3/1,6 sobre la secreción de IgA en pollos desafiados con Salmonella enteritidis.
Se seleccionaron cuatro artículos, se tomó la secreción de inmunoglobulina A (sIgA) y su correspondiente error estándar (SE) del grupo desafiado con Salmonella enteritidis y tratado con β-glucanos a diferentes dosis y diferentes esquemas en días, y comparados con un grupo control positivo a Salmonella enteritidis pero no tratados con β- glucanos, las aves evaluadas fueron 356 (pollos de engorde). Los cuatro artículos están publicados en inglés.
Tabla 3. Estudios seleccionados (n=4) para el metaanálisis efecto del uso de β-glucanos 1,3/1,6 sobre la producción de IgA en pollos desafiados con Salmonella enteritidis. Criterios de inclusión para hacer la evaluación estadística.
Análisis estadístico
Se medirá el análisis de varianza (ANOVA) para cuatro estudios seleccionados con la pregunta para la hipótesis nula (H0): el uso de β-glucanos 1,3/1,6, aumenta la secreción de inmunoglobulina A (sIgA), en respuesta a aves desafiadas con Salmonella enteritidis.
Modelo estadístico
yᵢⅉ=μᵢⅉ+ɛᵢⅉ
El análisis de los datos se realizará mediante la construcción de la tabla de análisis de varianza para el diseño de un solo factor completamente aleatorizado (Ducoing A.M. et al., 2016). El programa de software será el Stat Advisor para sIgA (ɲg/ml) Tratadas-Suma de cuadrados tipo III.
yᵢⅉ=Respuesta de la unidad experimental ⅉ del tratamiento ᵢ μᵢⅉ=Promedio de todas las respuestas de las unidades experimentales que recibieron el tratamiento ᵢ. ɛᵢⅉ=error residual de la unidad ⅉ que recibió el tratamiento ᵢ
Resultado
Gráfica 1. Secreción de IgA según las dosis de β-glucanos.
Secreción de IgA, a diferentes dosis de β-glucanos 1,3/1,6 (mg/k) usadas continuamente por periodos entre 1- 21 días de edad, la sIgA (ɲg/ml). (P=0,1735). mg/k= miligramos por kilogramo de peso vivo ɲg/ml= nanogramos por mililitro sIgA= Secreción de inmunoglobulina A
Gráfica 2. Secreción de IgA según las dosis de β-Glucanos comparados contra la gran media, calculando el límite superior (LS) por la prueba de Fisher.
Secreción de IgA, a diferentes dosis de β-glucanos 1,3/1,6 (mg/k) usadas continuamente por periodos entre 1- 21 días de edad, la sIgA (ɲg/ml) usando la prueba de Fisher. El análisis concluyente de la gran media ratifica que las dosis medias de β-1,3/1,6 generan un estímulo de respuesta con tendencia a incrementar sIgA según la dosis usada (p=0,4945) con diferencia significativa entre los tratamientos y la gran media, porque el límite superior (LS) de las concentraciones de 20 y 25 mg/k, están por encima del valor de la gran media.
mg/k= miligramos por kilogramo de peso vivo ɲg/ml= nanogramos por mililitro sIgA= secreción de inmunoglobulina A LS= límite superior de la gran media
Gráfica 3. Múltiples rangos para sIgA (ɲg/ml) tratadas por días de tratamiento.
Secreción de IgA, a diferentes dosis de β-glucanos 1,3/1,6 (mg/k) usadas continuamente por periodos entre 14, 15, -21 días de edad ɲg/ml= nanogramos por mililitro sIgA= secreción de inmunoglobulina A
Regresión simple – sIgA (ɲg/ml) tratadas vs. dosis (mg/k)
Variable dependiente: sIgA(ɲg/ml) tratadas Variable independiente: Dosis (mg/k) Logarítmico-Y Cuadrado-X: Y = exp(a + b*X^2)
Coeficiente de Correlación = -0,488146 R-cuadrada = 23,8286% R-cuadrado (ajustado para g.l.) = 11,1334% Error estándar del est. = 0,792344 Error absoluto medio = 0,603337 Estadístico Durbin-Watson = 1,64072 (P=0,1650) Autocorrelación de residuos en retraso 1 = 0,145545
Fórmula de regresión simple para el uso de β-glucanos. Stat Advisor
sIgA (ɲg/ml) Tratadas = exp (6,29421 - 0,0000900572*Dosis(mg/k)^2)
Gráfica 4. Modelo ajustado de regresión lineal.
Modelo ajustado de regresión lineal de dosis de β-glucanos 1,3/1,6 (tratadas), con la capacidad de secretar sIgA dependiendo de la dosis (20, 40, 60, 80, 100) mg/kg sIgA= Secreción de inmunoglobulina A mg/k= miligramos por kilogramo de peso vivo
Tabla 4. Eliminación de Salmonella en hígado.
Respuesta de la eliminación de Salmonella enteritidis con el uso β-glucanos 1,3/1,6 en pollos de engorde con uso continuo del día 1-21 de edad, desafiados a diferentes dosis y recuperación en macerados de hígados. sIgA= Secreción de inmunoglobulina A mg/k= miligramos por kilogramo de peso vivo.
Gráfica 5. Porcentaje de colonización en hígado de Salmonella enteritidis entre grupos control y grupos tratados con β-glucanos 1,3/1,6.
Control positivo (%) =Aves desafiadas con Salmonella enteritidis no tratadas. Β-glucanos (%) = Aves desafiadas con Salmonella enteritidis y medicadas con β- glucanos 1,3/1,6
Conclusiones
La inmunoglobulina A (IgA) se desempeña como la primera línea de defensa contra microorganismos patógenos y enterotoxinas, liberada en el epitelio intestinal, una de sus funciones es mantener la homeostasis de la mucosa intestinal, se ha reconocido por años que interfiere con el antígeno O bacteriano, bloqueándolo especialmente en los microorganismos Vibrio cholerae y Salmonella thypimurium (Mantis et al., 2011). En el presente estudio sobre el estímulo de la secreción de IgA (sIgA), a causa de los β-glucanos1,3/1,6 extraídos de la pared de levadura Sacharomyces cerevisiae, adicionada vía oral en pollos desafiados con Salmonella enteritidis, se demuestra que se incrementa la producción de IgA. Se ha inferido que al desafiar las aves con Salmonella thypimurium se estimula fuertemente la sIgA; de igual forma se ha investigado que al administrar β-glucanos 1,3/1,6 vía oral, se incrementa de sIgA en el lumen intestinal en aves desafiadas con Salmonella (Guo et al., 2003). El meta-análisis es concluyente y demuestra que la sIgA en aves desafiadas con Salmonella se aumenta a partir de 20 mg/kg (gráfica 1), para demostrar cuál es la dosis adecuada se corre la prueba de múltiples rangos analizando la variable de la gran media, cuyo criterio ratifica que las dosis medias de 20 mg/k -25mg/k son las de mayor capacidad secretoria de IgA, porque están por encima del límite superior de las medias al 95% (LSD > 95%) (gráfica 2). De igual manera, varios autores han corroborado el incremento en la secreción sIgA a diferentes dosis de β-glucanos (Shao et al., 2013). La confirmación de los datos anteriores nos dio las herramientas para calcular la ecuación de regresión lineal, para suplementar aves con β-glucanos1, 3/1,6 en pollos desafiados con Salmonella enteritidis.
[sIgA (ɲg/ml) Tratadas = exp (6,29421 - 0,0000900572*Dosis (mg/k) ^2)]
Además, al analizar por la prueba de Fisher a cuántos días se detecta el incremento de la secreción de sIgA, arroja que se obtiene a los 15 días post consumo de los β-glucanos 1,3/1,6, dicha farmacocinética es demostrada por Cox et al., 2010 (Vandeplas et al., 2010).
Por los argumentos anteriores, nuestro trabajo demuestra que el uso de β-glucanos 1,3/1,6 a una dosis de 25mg/k durante 15 días continuo, aumenta la secreción de sIgA en el intestino, que además es capaz de bloquear en un 79% la colonización de Salmonella enteritidis en el hígado.
Discusión
Algunos estudios publicados últimamente, demuestran la presencia de bacterias en el hígado que son provenientes de una translocación intestinal (Berg, 1995), con referencia a esta inferencia, este estudio ha demostrado que se incrementa la secreción de sIgA para bloquear la expresión local de la Salmonella spp, pero es muy importante anotar que en la mayoría de los casos el reto para el intestino puede ser causado por varias bacterias, como lo demuestran Remus et al. (2014), pues la contaminación intestinal que deteriora el crecimiento de las aves está distribuido de la siguiente manera: Clostridium spp 40%, Escherichia coli 10% y Salmonella spp 29,9%, pero no existen reportes del efecto sobre la secreción de la IgA y el daño al tejido intestinal. Por otro lado, Cox et al. (2010) demostró el fuerte impacto que tiene un desafío de Coccidias spp, gracias a los avances en la investigación sobre los inmunomoduladores en la última década. Es importante considerar a los β-glucanos 1,3/1,6 provenientes de la pared de levadura (Sacharomices cereviciae) como una herramienta para inmunomodular la respuesta de los pollos de engorde y su inmunidad celular, como lo demuestran Cox et al. (2010), donde la respuesta de la citoquina INF-ɣ es regulada cuando las aves son desafiadas con coccidia en duodeno, yeyuno e íleon, permitiendo de esa manera un adecuado funcionamiento del sistema inmune.
Referencias bibliográficas
Berg, R.D. Bacterial translocation from the gastrointestinal tract. Trends Microbiol, 3:149-154, 1995.
Catalioto, R.M.; Maggi, C.A.; Giuliani, S. Intestinal epithelial barrier dysfunction in disease and possible therapeutical interventions. Curr. Med. Chem. 18:398-426, 2011.
Chae, B.J.; Lohakare, J.D.; Moon, W.K. et al. Effect of supplementation of ß-glucan on the growth performance and immunity in broilers. Res. Vet. Sci. 80:291-298, 2006.
Chen, K.L.; Weng, B.C.; Chang, M-T. et al. Direct enhacement of the phagocytic and bactericidal capability of abdominal macrophaghes of chickens by β-1,3/1,6 glucans. Poultry science, 87: 2242-2249, 2006.
Cheung, N.-K.; Modak, S.; Vickers, A. et al. Orally administered ß-glucans enhance anti-tumor effects of monoclonal antibodies. Cancer Immunol. Immunother, 51: 557-564, 2002.
Cox, C.M.; Stuard, C.H.; Kim, S. et al. Immune responses to dietary beta glucan in broiler chicks during an Eimeria challenge. Poult. Sci, 89: 2597-260, 2010ª.
Ducoing A.M. Diseño estadístico de experimentos. Estadística para veterinarios y zootecnistas NEWTON. PP 207, 2016.
Glynn, M.K.; Bopp, C.; Dewitt, W. et al. Emergence of multidrug-resistant Salmonella enterica serotype Typhimurium DT104 infections in the United States. New England Journal of Medicine, 338, 1333-1338, 1998.
Griffin, A.J.; McSorley, S.J. Development of protective immunity to Salmonella, a mucosal pathogen with a systemic agenda. Mucosal Immunol, 4:371-382, 2011.
Grimont, P.A.D.; Grimont, F.; Bouvet, P. Taxonomy of the genus Salmonella. In: Wray, A. and Wray, C. (eds.) Salmonella in domestic animals. CAB, International, Oxford, England, p. 1-17, 2000.Guo, Y.; Ali, R.A.; Qureshi, M.A. The influence of ß-glucan on immune responses in broiler chicks. Immupharmacol. Immunotoxicol, 3:461-472, 2003.
Guo, Y.; Ali, R.A.; Qureshi, M.A. The influence of beta glucan on immune responses in broiler chicks. Immunopharma col Immunotoxicol, 25:461-472, 2003.
Huff, G.R.; Huff, W.E.; Rath, N.C. et al. Limited treatment with beta-1,3/1,6-glucan improves production values of broiler chickens challenged with Escherichia coli. Poult. Sci, 85:613-618, 2006.
Instituto Nacional de Salud. Perfil de riesgo Salmonella spp. (no tifoideas) en pollo entero y en piezas. Ministerio de Protección Social, p. 68, 2011.
Li, X.H.; Chen, Y.P.; Cheng. Y.F. et al. Effect of yeast cell power with different particle sizes on the growth performance. Serum metabolites. Immunity and oxidative status of broiler. Animal Feed Science and Thechnology. p. 81-89, (2015).
Lowry, V. K.; Farnell, M.B.; Ferro, P.J. et al. Purified ß-glucan as an abiotic feed additive up-regulates the innate immune response in immature chickens against Salmonella enterica serovar Enteritidis. Int. J. Food Microbiol, 98:309-318, 2005.
Manners, D.J.; Masson, A.J.; Patterson, J.C. et al. The structure of a beta-(1–6)-d-glucan from yeast cell walls. Biochem. J, 135:31-36, 1973.
Mantis, N.J.; Rol, N.; Corthesy, B. Secretory IgA’s complex roles in immunity and mucosal homeostasis in the gut. Mucos Immunol, 4:603-611, 2011.
Mead, P.S.; Slutsker, L.; Dietz, V. et al. Food-related illness and death in the United States. Emerging and Infection Diseases, 5, 607-625, 1999).
Remus, A.L.; Hatchild, I.; Andretta, M. Kipper. A Meta Analysis of the feed intake and grow performance of broiler chickens challenged of bacterials. Poultry Science, 93:1149-1158, 2014.
Shao, Y.; Guo, Y.; Wang, Z. Yeast D Glucan induced microbial peptide Expression against Salmonella infection. Poult. Sci, 92, 1764-1773, 2013.
Soltanian, S.; Stuyven, E.; Cox, P et al. Beta-glucans as immunostimulant in vertebrates and invertebrates. Crit. Rev. Microbiol. 35:109-138, 2009.
Tsukita, S.; Furuse, M.; Itoh, M. Multifunctional strands in tight junctions. Nat. Rev. Mol. Cell Biol. 2:285-293, 2001.
Ulluwishewa, D.; Anderson, R.C.; McNabb, W.C. et al. Regulation of tight junction permeability by intestinal bacteria and dietary components. J.Nutr. 141:769-776, 2011.
Uzzau, S.; Brown, D.J.; Wallis, T. et al. Host adapted serotypes of Salmonella enterica. Epidemiology and Infection, 125, 229-255, 2000.Vandeplas, S.; Dubois, R.; Dauphin, Y. et al. Salmonella in chicken: Current and developing strategies to reduce contamination at farm level. J. Food Prot, 73:774–785.
Volman, J.J.; Ramakers, J.D.; Plat, J. Dietary modulation of immune function by beta-glucans. Physiol. Behav, 94:276-284, 2008.
Como citar: Salazar, J.J.; Urrea-Uribe, G.; Ramírez, J.D.; Mejía, L.M. Metaanálisis: Efecto inmunomodulador sobre la IgA, generado por los β-glucanos 1,3/1,6 (Sacharomices cerevisiae), en pollos de engorde, desafiados con Salmonella enterica. Revista Veterinaria y Zootecnia, v. 13, n. 1, p. 68-82, 2019. DOI: 10.17151/vetzo.2019.13.1.5 http://vetzootec.ucaldas.edu.co/index.php/component/content/article?id=266
Esta obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|