|
Diarrea neonatal bovina en un hato del altiplano norte de Antioquia (Colombia), un estudio descriptivo1
ARTÍCULO DE
(Recibido: 26 de Noviembre de 2014 Aprobado: 22 de Abril de 2015 Actualizado: 03 de julio de 2015)
DOI: 10.17151/vetzo.2014.8.2.9
RESUMEN: La diarrea neonatal bovina es una enfermedad cuya etiología puede ser infecciosa o no infecciosa, afecta los neonatos bovinos especialmente durante las tres primeras semanas de vida y causa serias pérdidas económicas en el sector lechero a nivel mundial. En este estudio se describió la enfermedad en un hato de producción lechera en el altiplano norte de Antioquia. Se evaluó una cohorte de 60 terneros durante su primer mes de vida mediante examen clínico, análisis hematológicos, de serología, y ELISA en materia fecal para Cryptosporidium parvum, rotavirus bovino tipo A, coronavirus bovino y E. coli K99. Adicionalmente, se estimó la concentración de inmunoglobulinas en el calostro suministrado y la transferencia pasiva de inmunoglobulinas. Se encontraron proporciones de morbilidad por diarrea de 94,92%, mortalidad general de 17,58% y letalidad del 15,79%. Entre los animales enfermos se encontró un porcentaje de 89,47%, 47,37%, 7,02% y 0% para cada agente patógeno respectivamente. Se evidenció un alto porcentaje de animales con linfocitos reactivos, lo que indica la infección con agentes parasitarios o virales. Los resultados obtenidos en este estudio sugieren que puede existir circulación de agentes involucrados en la diarrea neonatal bovina en la zona, lo que genera preocupación por el desconocimiento del estatus sanitario del altiplano norte de Antioquia en general.
Palabras clave: Cryptosporidium parvum, ELISA, inmunidad pasiva, rotavirus bovino
Bovine neonatal diarrhea in a herd in the Northern Antioquia (Colombia) Highlands, a descriptive study
ABSTRACT: Bovine neonatal diarrhea is a disease, with etiology that can be infectious or non-infectious, which affects calves during the first three and causes serious economic losses in the dairy industry worldwide. This study describes the disease in a dairy herd in the Northern Antioquia Highlands. A cohort of 60 calves was evaluated during the first month of life through clinical examinations, haematological and serology analysis, and ELISA in fecal samples to detect Cryptosporidium parvum, bovine rotavirus type A, bovine coronavirus and E. coli K99. Additionally, the concentration of immunoglobulin in the colostrum administered and the passive transfer of immunoglobulin were estimated. Proportions of morbidity because of diarrhea were 94.92%, general mortality 17.58%, and lethality 15.79%. Among the group of sick animals 89.47%, 47.37%, 7.02% and 0% were found for each pathogenic agent respectively. A high percentage of animals with reactive lymphocytes were observed which indicates parasitic or viral infection. The results obtained from this study suggest that circulation of agents involved in bovine neonatal diarrhea can exist in the area, which generates concern because of the unknown sanitary status in the Northern Antioquia Highlands.
Key words: bovine rotavirus, Cryptosporidium parvum, ELISA, passive immunity
Introducción
La diarrea neonatal bovina (DNB) genera pérdidas económicas en la industria láctea debido a la alta morbilidad, retraso en el crecimiento y los altos costos en el tratamiento (Lundborg et al., 2005; Afshari et al., 2012; Aguirre, 2012). Es un cuadro clínico gastrointestinal común y complejo que afecta a los animales recién nacidos, especialmente durante la segunda y tercera semana de vida, donde se presentan alrededor del 70% de los casos (Baquero-Parrado, 2008; Hernández, 2010). Este complejo es causado por una gran variedad de condiciones (ambientales, nutricionales, genéticas); y, por lo general, no es exclusivo de un solo agente; de esta manera, su presentación está influenciada por las características intrínsecas del animal, su estatus nutricional e inmunológico, el manejo del hato, el medio ambiente y la variedad de agentes infecciosos involucrados (Hernández, 2010; Pardo, 2012).
Históricamente, la DNB ha sido atribuida principalmente a los agentes infecciosos: rotavirus bovino tipo A (RVB-A), coronavirus bovino (CVB), virus de la diarrea viral bovina (VDVB), Salmonella spp., Escherichia coli (K99), Clostridium perfringens tipo C, Cryptosporidium parvum y otras especies de Coccidia sp. (Cho et al., 2013). La transmisión de estos agentes ocurre por vía oral-oral en los primeros días de vida cuando el neonato consume calostro directamente de la madre infectada o permanece en lugares donde la vaca ha defecado. El principal síntoma de los individuos afectados es diarrea de consistencia blanda o líquida, en algunos casos es de tipo hemorrágico (Ganaba et al., 1995; Trotz-Williams et al., 2007; Boileau & Kapil, 2010). En general, la diarrea ocurre por mala absorción debido al daño completo de la célula epitelial infectada, a la alteración de los mecanismos de absorción o al aumento de las secreciones celulares, siendo en este último caso una diarrea por hipersecreción. Otros síntomas clínicos incluyen depresión, debilidad, anorexia y deshidratación que puede variar entre 8 y 10%, además de alteraciones de los parámetros sanguíneos, como aumento del volumen del paquete celular y el conteo de leucocitos totales, lo cual sugiere deshidratación. Además, hay reportes de neutrofilia y leucocitosis en estadios tempranos de la diarrea (Malik et al., 2013). En 6 a 12 horas se pueden producir desequilibrios electrolíticos donde predominan la hiperkalemia e hiponatremia, acidosis metabólica, insuficiencia circulatoria, shock y muerte (Ganaba et al., 1995; Boileau & Kapil, 2010).
El diagnóstico de los agentes infecciosos se ha realizado a través de diferentes técnicas de laboratorio como aislamiento viral, microscopía electrónica, ELISA, cultivo de bacterias, microscopía directa sobre extendidos de materia fecal con tinción para agentes ácido-alcohol resistentes (Ziehl Neelsen) y técnicas de flotación (Pardo, 2012; Cho et al., 2013). Otras técnicas diagnósticas basadas en la detección de ácidos nucleicos como PCR, RT-PCR e inmunofluorescencia han tenido gran acogida, dado que incrementan la sensibilidad y la rapidez en el diagnóstico (Cho et al., 2013).
El objetivo de este estudio fue caracterizar la enfermedad diarreica neonatal en términos de agentes infecciosos involucrados, parámetros sanguíneos alterados y transferencia de inmunidad pasiva; en bovinos de un hato en una zona de alta producción lechera del departamento de Antioquia (Colombia).
Materiales y Métodos
El estudio fue realizado en un hato especializado de producción de leche ubicado en el municipio de Belmira, en el Norte del departamento de Antioquia (Colombia) en una zona de vida de Bosque húmedo Montano Bajo (Bh-MB), a una altura de 2550 msnm y con temperatura promedio de 14°C (Holdridge, 1967). La pastura predominante es Pennisetum clandestinum.
Los neonatos son separados de las vacas durante el primer día posparto después de consumir calostro y llevados a terneriles, donde conviven con animales de hasta una semana de edad; luego, salen a potrero donde son manejados con animales de hasta un mes de edad. La alimentación consiste en calostro durante los tres primeros días y, posteriormente, cuatro litros diarios de leche hasta los tres meses de edad.
Un grupo de animales (n = 60) (40 hembras y 20 machos), nacidos en el periodo mayo a julio de 2013, fueron observados durante su primer mes de vida. Los animales fueron en un 50% de raza Jersey, 10% Holstein y el restante 40% cruces de las razas Jersey, Holstein y Pardo Suizo.
En la primera hora posparto se colectó de cada madre una muestra de calostro de 450 ml en promedio para el análisis inmediato de inmunoglobulinas. Entre las primeras 56 horas posteriores al nacimiento (Pardo, 2012), a cada neonato se le extrajo una muestra de suero sin anticoagulante, que fue congelada (-20ºC) hasta el análisis de la transferencia pasiva de inmunoglobulinas (TPI).
La definición de caso clínico fue: aquellos terneros con cuadros caracterizados por la excreción de heces fluidas, frecuentes, abundantes; y con anorexia (Pardo, 2012). Se midió el tiempo en días desde el nacimiento hasta el inicio de la diarrea. Una vez detectado el caso y antes del inicio de cualquier tratamiento, se colectaron muestras de materia fecal directamente del recto, las cuales fueron colocadas en frascos de coprológico estériles. Todos los animales fueron muestreados de igual forma al mes de vida para análisis por ELISA. Las muestrasse conservaron en tubos de microcentrífuga a -20°C, para el análisis. Fueron incluidos aquellos animales que presentaron el cuadro clínico, hijos de vacas de dos partos o más. Se excluyeron animales que presentaran cualquier tipo de manifestación clínica de enfermedad diferente a diarrea.
A los animales les fueron tomadas muestras de sangre por punción de la vena yugular y colocadas en tubos con y sin anticoagulante ácido etilendiaminotetraacético (EDTA) para las pruebas hematológicas y químicas respectivamente, se remitieron a la Unidad de Diagnóstico Veterinario de la Universidad de Antioquia para su análisis.
Para el trabajo con los animales se obtuvo aval del Comité de Ética para la Experimentación con Animales de la Universidad de Antioquia, mediante Acta N° 78 del 09 de agosto de 2012.
Para la aproximación a la concentración de inmunoglobulinas en calostro se empleó un calostrómetro (Biogenics, Mapleton, EUA). Se colocaron 500 ml de calostro a 20°C en el recipiente y se siguieron las instrucciones de medición establecidas por el fabricante y reportadas en la literatura, que indica que los resultados pueden ser registrados en mg Ig/ml y con valores cualitativos (excelente, aceptable o pobre calidad) (Harp et al., 1995; Aguirre, 2012).
Para la aproximación a la concentración de inmunoglobulinas séricas se empleó la prueba de precipitación de sulfito de sodio. Se prepararon tres soluciones de sulfito de sodio al 14, 16 y 18% en agua destilada. Posteriormente, se colocaron 1,9 ml de cada solución en tres tubos de ensayo y se adicionó 0,1 ml de suero sanguíneo a cada uno, mezclando muy bien. La interpretación del nivel de inmunoglobulinas séricas se realizó de la siguiente manera: precipitación en los tres tubos (adecuado, ≥1500 mg Ig/dl de suero), en los tubos con 16 y 18% (aceptable, 500-1500 mg Ig/dl de suero), solo en el tubo 18% o ninguna precipitación (pobre o nula, ≤500 mg Ig/dl de suero) (Weaver et al., 2000a; García et al., 2006). Se utilizaron sueros de animales recién nacidos como controles negativos de la prueba, colectados previo al consumo de calostro, mientras que como controles positivos de la prueba fueron utilizados sueros de animales sanos de un mes de edad.
Todas las muestras de materia fecal fueron examinadas mediante ELISA, para el antígeno de cuatro agentes patógenos que han sido reportados como involucrados en la DNB: RVB-A, CVB, E. coli (K99) y C. parvum; usando un kit comercial (Bio-X Diagnostics, Jemelle, Bélgica). El procedimiento se realizó siguiendo las instrucciones del fabricante. La lectura se realizó con el Espectrofotómetro para Microplacas Epoch (BioTek Instruments, Winooski, EUA). La sensibilidad del test para C. parvum, CVB, RVB-A y E. coli (K99) es de 100, 93, 97 y 100% respectivamente, la especificidad es de 88, 96, 100 y 100% en el mismo orden, de acuerdo con el fabricante.
Se analizaron 22 parámetros en el hemograma de las muestras de sangre con anticoagulante (descritos más adelante) y hallazgos celulares anormales como siderocitos, macroplaquetas, cuerpos de Howell-Jolly, linfocitos reactivos, entre otros. El hemograma fue realizado por el método de Impedancia Eléctrica en el equipo Abacus junior VET 5 (Diatron, Budapest, Hungría), adicionalmente se hizo recuento visual por microscopía óptica a un aumento de 1000X sobre el extendido de sangre (Olympus, Tokio, Japón). Los valores de creatinina sérica, urea y aspartato aminotransferasa (AST) fueron medidos por turbidimetría usando el equipo Analyzer A15 (Biosystems, Barcelona, España).
Se realizaron análisis descriptivos de todas las variables en estudio. Se realizó la prueba de Shapiro-Wilk para evaluar distribución normal de los datos y de acuerdo a ello se calcularon medias o medianas, desviaciones estándar e intervalos de confianza del 95%, para las variables: concentración de inmunoglobulinas en calostro, tiempo al inicio de la diarrea, recuento de leucocitos, recuento de linfocitos, recuento de células intermedias, recuento de granulocitos, linfocitos, monocitos, neutrófilos, eosinófilos, basófilos, bandas, recuento de eritrocitos, hemoglobina, hematocrito, volumen corpuscular media, hemoglobina corpuscular media, concentración de hemoglobina corpuscular media, amplitud de distribución eritrocitaria, recuento de plaquetas, plaquetocrito, volumen plaquetario medio, amplitud de distribución plaquetaria, proteínas plasmáticas, creatinina sérica, nitrógeno ureico en sangre, úrea y aspartato aminotransferasa. Se establecieron proporciones para las variables: presencia de macroplaquetas, hipocromía, poiquilositosis, crenocitos, acantocistos, eritroblastos, policromatofilia, cuerpos de Howell-Jolly, siderocitos, agregados plaquetarios, linfocitos reactivos, calidad del calostro y la TPI (excelente, aceptable y pobre o nula), presencia de diarrea, mortalidad, letalidad (cociente entre el número de animales que murieron a causa de la enfermedad y el número de animales enfermos), presencia de cada agente infeccioso, coinfección y diferencia entre lecturas. Todos los análisis fueron realizados en el programa estadístico STATA SE 13.0 (StataCorp, Texas, EUA).
Resultados y Discusión
Al evaluar el calostro de las madres, 57 (95%) tenían calostro de calidad aceptable a excelente y solo tres (5%) presentaron calostro de mala calidad. La prueba de sulfito de sodio arrojó que 54 (89,47%) animales presentaron una absorción de inmunoglobulinas adecuada (concentración aproximada >1500 mg Ig/dl) y solo tres (5,26%) presentaron absorción pobre o nula (concentración aproximada <500 mg Ig/dl).
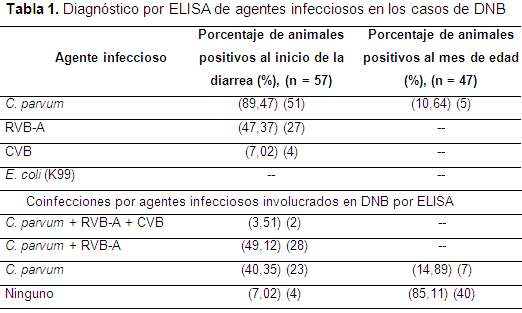
Se encontró que 57 terneros presentaron diarrea, lo que corresponde a una prevalencia de 94,9%. Todos los casos iniciaron antes de finalizar la segunda semana de vida, el inicio se dio en promedio a los 7,4 días (IC95% 6,87-8,01). Se registró una mortalidad de 10 animales (17,58%). En la Tabla 1 se muestran los resultados del diagnóstico de agentes infecciosos, así como las coinfecciones encontradas. Tres animales (5%) que no presentaron diarrea, fueron negativos a todos los patógenos.
En los análisis de hematología y química sanguínea de los animales que presentaron DNB no se encontraron parámetros alterados cuando se compararon con los valores de referencia del laboratorio. Cuando se compararon con los valores de referencia utilizados por la Unidad de Diagnóstico. Se encontraron agregación plaquetaria (5,88%) y linfocitos reactivos (52,94%).
Como se reporta en la literatura, la DNB en este caso es la principal enfermedad que afecta los terneros durante las primeras semanas de vida. Sin embargo, contrario a otros estudios donde se reporta que el cuadro clínico inicia entre la segunda y tercera semana de vida, la diarrea inició desde la primera semana de vida y todos los casos se presentaron antes de finalizar la segunda semana, con un promedio de inicio de 7,4 días (Trotz-Williams et al., 2008; Baumgartner, 2012).
Según los reportes de la literatura la morbilidad y la mortalidad pueden variar entre estudios, en este caso la morbilidad del 94,92% se encontró por encima de los valores más altos reportados con un 80% en otros países y muy por encima de los valores reportados en estudios realizados en el país donde se reporta como máximo una morbilidad del 37,5% en Antioquia, un 26,10% y 10,3% en la Sabana de Bogotá (Escobar & Oliver, 1997; Pardo, 2012). La mortalidad de igual forma es variable y aunque no es tan alta como lo reportado en otros países donde se habla hasta de un 75% (Von Buenau et al., 2005), sí se encontró con valores más altos comparados con reportes de mortalidad general en terneros durante los primeros meses de vida con un máximo de 11,5% en la Sabana de Bogotá (Pardo, 2012). Esto sugiere que las condiciones de manejo de la granja podrían ser las responsables del incremento de los casos como se ha reportado en la literatura para otros lugares (Trotz-Williams et al., 2007; Pardo, 2012).
Por otro lado, la calidad del calostro no sería una de las causas de estas altas proporciones de morbilidad y mortalidad pues los resultados muestran una adecuada TPI, acorde con lo reportado por varios autores (Weaver et al, 2000b; Wallace et al., 2006; Trotz-Williams et al., 2007). En los casos donde la TPI fue pobre, dos de los terneros murieron. La morbilidad tan alta podría indicar que la diarrea y la respuesta inmunológica por parte del neonato, dependerían de otros factores como las particularidades de los agentes etiológicos involucrados.
En un estudio de la Sabana de Bogotá, al realizar el diagnóstico tanto en animales sanos como enfermos se encontró una proporción de positividad de 38,3%, 19,7%, 7,5% y 0,75% a Cryptosporidium sp., RVB-A, E. coli (K99) y CVB respectivamente, diagnosticados por la técnica de ELISA (Pardo, 2012). En el presente estudio, de igual manera el Cryptosporidium parvum fue el agente de mayor importancia seguido por el RVB. Sin embargo, en este caso no se presentaron animales positivos a E. coli (K99) y la proporción de positividad a los otros tres agentes fue superior. Esto podría deberse a que para este trabajo únicamente se diagnosticó una granja, lo que implica una posible mayor carga de patógenos inherente a las condiciones de manejo, producción y medio ambiente del hato. Al igual que en el estudio de la Sabana de Bogotá y en otros reportes de la literatura, la coinfección entre dos o más agentes patógenos es común encontrarla en el cuadro diarreico, siendo una de las de mayor proporción la combinación Cryptosporidium parvum y RVB-A (Cho et al., 2013).
El 90% de los animales fueron positivos a Cryptosporidium parvum, el cual se considera uno de los parásitos más comúnmente hallados en casos de DNB (Cho et al., 2013; Cho & Yoon, 2014). Sin embargo, no es el calostro el que puede ofrecer alguna protección (Weaver et al., 2000b; Cho & Yoon, 2014), ya que los animales expuestos al parásito durante la primera semana de vida desarrollan diarrea y eliminan ooquistes; como el sistema inmunológico en la mucosa del íleon en neonatos bovinos es inmaduro e incapaz de responder a la infección, así el calostro contenga una buena concentración de inmunoglobulinas tipo IgG, IgA e IgM y la TPI ocurra adecuadamente, este parásito es capaz de inducir la diarrea (Wyatt, 2000). Según Wyatt, la diarrea inducida por Cryptosporidium puede deberse a que la colonización de las células intestinales ocurre predominantemente por linfocitos T γδ y hay relativamente pocos linfocitos TCD4+ y CD8+. Adicionalmente, esta población de linfocitos tiene un fenotipo sIgM+, que inmunológicamente no responde de forma efectiva contra C. parvum (Wyatt, 2000). Durante la fase aguda de la criptosporidiosis se da el reclutamiento de los linfocitos CD4+ y CD8+ en la mucosa del íleon y el cambio de isotipo de las células B para producir IgA, IgG1 e IgG2 se da hacia la segunda semana de vida, cuando la mucosa ya está infectada. Estas células son necesarias para poner fin a la infección con eficacia (Wyatt, 2000).
En este estudio la lectura de las pruebas de ELISA se realizó al momento del inicio del cuadro clínico, reportando una alta proporción de exposición de Cryptosporidium parvum y RVB-A, que puede sugerir una coinfección, como ha sido reportado en otros estudios (Pardo, 2012; Cho et al., 2013).
Por el tiempo promedio para el inicio de la diarrea que en este caso fue de 7,4 días, se podría hipotetizar que el agente causante inicial fue el RVB-A (52%), ya que se ha reportado como el agente que afecta a los animales principalmente durante la primera semana de vida, facilitando la colonización de otros agentes patógenos en la segunda y tercera semana de edad (Bicknell & Noon, 1993; Pardo, 2012; Cho & Yoon, 2014), tiempo para el cual la presencia de Cryptosporidium parvum en mucho más común como agente involucrado si se compara con otros periodos (Avendaño et al., 2014).
La infección por Cryptosporidium parvum se debe a factores de riesgo reportados por Trotz-Williams et al. (2007) y Pardo (2012). En este caso, la infección se podría asociar con el consumo de calostro directamente desde la ubre la cual se puede contaminar con materia fecal, además la permanencia del neonato con la madre por más de una hora después del nacimiento aumenta la posibilidad de infección. En las observaciones realizadas en este estudio, los neonatos permanecieron con la madre durante el primer consumo de calostro, esto explicaría la exposición temprana al parásito y el desarrollo de signos clínicos después de los 6 días siguientes a la exposición, como lo reporta la literatura (Wyatt et al., 2010).
Los análisis hematológicos presentaron alteraciones en cuanto se presentó una alta proporción de animales enfermos con linfocitos reactivos, mas no otros parámetros, contrario a lo que reporta la literatura durante los cuadros de diarrea debido a la infección y a la deshidratación que ocurre (Baquero-Parrado, 2008; Malik et al., 2013; Cho & Yoon, 2014). La explicación a esta situación podría estar apoyada en que las muestras de sangre fueron colectadas al inicio del cuadro clínico, y para ese momento es posible que las alteraciones en los perfiles hematológicos aún no se hayan presentado. Según la literatura, cuando se presentan abundantes linfocitos reactivos es porque el animal está siendo estimulado antigénicamente, son indicadores del inicio de una infección causada principalmente por virus y parásitos y son característicos en la respuesta frente a la infección por Cryptosporidium parvum y RVB-A (Harp et al., 1995).
Conclusiones
Se evidencia la presencia de varios agentes causales de DNB. Ante el desconocimiento de la situación de la enfermedad en la región, se pone de manifiesto la necesidad de realizar un estudio epidemiológico amplio que permita comprender la ocurrencia, la etiología infecciosa y los factores asociados no infecciosos en el altiplano norte.
Agradecimientos
A los recursos del Fondo de Sostenibilidad CODI - U. de A. 2014-1015; a la administración y empleados de la Finca El Pantano por el apoyo en el trabajo de campo; y al estudiante de Medicina Veterinaria, Juan Diego Vásquez Serna.
Referencias Bibliográficas
Cadavid-Betancur, D.A.; Giraldo-Echeverri, C.A.; Sierra-Bedoya, S.; Montoya-Pino, M.; Chaparro-Gutiérrez, J.J.; Restrepo-Botero, J.E.; Olivera-Ángel, M. Diarrea neonatal bovina en un hato del altiplano norte de Antioquia (Colombia), un estudio descriptivo. Veterinaria y Zootecnia, v.8, n.2, p.120-129, 2014. Disponible en: |