|
Efecto in vitro del aceite de girasol (Helianthus annuus L.) sobre ácido transvacénico y patrón de ácidos grasos de cadena larga en la digesta ruminal
Juan Pablo Vélez-Ruiz
1 Joven investigador Colciencias. 2Estudiante de doctorado en Ciencias Agrarias, Universidad de Caldas. 3Departamento de Producción Agropecuaria y Grupo de Investigación CIENVET, Universidad de Caldas, Manizales, Colombia
This email address is being protected from spambots. You need JavaScript enabled to view it.
Recibido: 23 de Septiembre de 2016 y Aprobado: 15 de Diciembre de 2016 y Actualizado: 15 de Junio de 2017
DOI: 10.17151/vetzo.2017.11.1.4
RESUMEN: La adición de aceites vegetales ricos en ácidos grasos de cadena larga (AGCL) a las dietas para rumiantes se ha propuesto como alternativa para disminuir las emisiones de metano (CH4) y aumentar los niveles de ácido linoleico conjugado (ALC) en la leche y la carne, que está mediado por la producción a ácido transvacénico (ATV) en el rumen. El objetivo de este estudio fue evaluar el efecto de la adición de aceite de girasol en proporciones de 0%, 1% y 3% (con base en MS) a substratos de fermentación in vitro (técnica de producción de gas): pasto Kikuyo (Pennisetum clandestinum) o pasto Ryegrass (Lolium perenne), sobre la cinética de producción de gas, la producción de CH4, la concentración de ácidos grasos volátiles (AGV), la producción de ALC y ATV y otros ácidos grasos de cadena larga (AGCL). La adición de aceite de girasol (1% y 3%) no disminuyó la producción de gas (A) ni la tasa de producción de gas (c); sin embargo, sí aumentó el tiempo de retardo en el inicio de la producción de gas (0,042, 0,425 y 0,564 h para control, 1% y 3%, respectivamente; P<0,001). La adición de aceites tampoco redujo la producción de CH4. No obstante, la adición de aceite incrementó ligeramente el porcentaje de ácido propiónico (22,0, 22,5 y 22,6% para control, 1% y 3%, respectivamente; P<0,05). La proporción de ácido linoleico conjugado (ALC) no varió como consecuencia de la adición de aceite, pero la proporción de ácido transvacénico (ATV) sí se incrementó significativamente en respuesta a la adición el aceite (13,4, 16% y 21,8% para control, 1% y 3%, respectivamente; P<0,01). La inclusión de aceite de girasol a niveles del 1 y 3% sobre la materia seca aumentó la producción de ATV a nivel ruminal sin afectar negativamente las variables que caracterizan la fermentación ruminal.
Palabras clave: ácido linoleico, fermentación ruminal, nutracéuticos, reducción de metano
In vitro effect of sunflower oil (Helianthus Annuus L.) on transvacenic acid and long chain fatty acid pattern in ruminal digesta
ABSTRACT: The addition of vegetable oils rich in long chain fatty acids (LCFA) to ruminant diets has been proposed as an alternative to reduce methane (CH4) and increase levels of conjugated linoleic acid (CLA) in milk and meat, that is preceded by the production of transvacenic acid (TVA) in the rumen. The objective of this study was to evaluate the effect of the supplementation of sunflower oil in proportions of 0%, 1% and 3% (DM bases) to in vitro fermentation substrates (gas production technique): Pennisetum clandestinum or Lolium perenne, on the kinetics and total gas production, CH4 production, concentration of volatile fatty acids (VFA), production of CLA and TVA and the pattern of long chain fatty acids (LCFA). Addition of sunflower oil (1% and 3%) did not decrease gas production (A) or gas production rate (c); however, it increased the time delay to start fermentation (L, 0.042, 0.425 y 0.564 h for control, 1% y 3%, respectively; P<0.001). Oil addition also did not reduce production of CH4. Nevertheless, it slightly increased the percentage of propionic acid (22, 22.5 y 22.6% for control, 1% y 3%, respectively; P<0.05). The proportion of conjugated linoleic acid (CLA) did not change because of the supplementation of oil, but the proportion of transvacenic acid (TVA) increased significantly in response to the addition of oil (13.4, 16% y 21.8% for control, 1% y 3%, respectively; P<0.01). The inclusion of sunflower oil at levels of 1 and 3% of the dry matter increased ruminal production of TVA without affecting negatively the variables that characterize the ruminal fermentation.
Key words: linoleic acid, ruminal fermentation, nutraceuticals, reduction of methane
Introducción
En la actualidad se observa que los consumidores de alimentos de origen bovino muestran tendencia a substituir dichos alimentos por otros con menor cantidad de lípidos saturados y colesterol, y a considerar que esta fuente de lípidos conduce necesariamente a presentación de enfermedades cardiovasculares y a la tumorigénesis; sin embargo, un componente de este lípido, el ácido linoleico conjugado (ALC) ha mostrado actividad anticarcinogénica en ratas (Corl et al., 2001) y en humanos (Belury, 2002; Dilzer & Park, 2012). También es un buen agente antiarteriosclerótico, antiinflamatorio, antidiabético y potenciador del sistema inmune (Dilzer & Park, 2012) e inhibe la síntesis de ácidos grasos, reduciendo la acumulación de grasa corporal en individuos con sobrepeso (Weiss et al., 2004; McCrorie et al., 2011).
El ALC se origina en el rumen como resultado de la biohidrogenación incompleta del ácido linoleico y del ácido linolénico de origen alimentario (Kepler et al., 1966; Toral et al., 2016; Palmquist, 2007); aunque también puede sintetizarse endógenamente en la glándula mamaria a partir del ácido transvacénico (ATV) que también aparece en el rumen como producto de la biohidrogenación incompleta de los ácidos grasos C18 poliinsaturados (Corl et al., 2001; Gomez-Cortes et al., 2011; Prieto-Manrique et al., 2016b). Por lo tanto, la presencia del ALC en los alimentos de origen bovino depende de las condiciones de alimentación de los animales (Mele et al., 2006; Prieto-Manrique et al., 2016a) y está estrechamente relacionada con la composición en ácidos grasos de los alimentos ingeridos. Se considera que los suplementos lipídicos con altos contenidos de ácido linoleico y alfa-linolénico (como los procedentes de semillas de soya, algodón, girasol, lino, cártamo y colza) son los más indicados para aumentar el ALC en leche (Khanal & Dhiman, 2004).
Adicionalmente, se ha documentado que en los rumiantes el aumento en el consumo de dichos ácidos grasos es ambientalmente relevante debido a que pueden inducir la disminución en la producción de metano (CH4) ruminal (Beauchemin et al., 2009; Jalc et al., 2007; Toprak, 2015) hasta en un 50% (Machmüller et al., 1998), y que la depresión en la producción de CH4 es mayor cuando aumentan las instauraciones en los ácidos grasos C:18 (Cosgrove et al., 2008). El interés por reducir la emisión de metano está dado por su mayor potencia para generar calentamiento global (21 veces mayor que el CO2) (IPCC, 2007) y porque constituye entre 50 a 80% de la huella de carbono de los alimentos provenientes de los rumiantes (Moss et al., 2000; Flachowsky & Kamphues, 2012); también porque éste constituye una pérdida de la energía consumida de entre 4 y 10% con extremos de 2 a 15% (Patra & Yu, 2013).
El objetivo del estudio fue determinar el efecto de la adición de aceite de girasol (Helianthus annuus L.) sobre la producción de ALC y de ATV, y de CH4 en las condiciones de ambiente ruminal provocadas por pastos propios de trópico frío.
Materiales y Métodos
El trabajo se desarrolló usando la técnica de producción de gas (Elghandour et al., 2015; López et al., 2007; Theodorou et al., 1994).
Substrato de fermentación: se utilizaron como substratos de fermentación dos pastos de trópico frío: Kikuyo (Pennisetum clandestinum) y Ryegrass (Lolium perenne); de cada uno de ellos se recolectaron tres muestras independientes (500 g), en estado de prefloración y usando un método de muestreo que imitaba en la altura el patrón de consumo exhibido por los animales en los lotes aledaños recién pastoreados.
La mitad de cada muestra (250 g) de pasto fue picada (5 cm), congelada (-26°C), liofilizada, molida (1 mm) y usada como substrato de fermentación; la otra porción (250 g) fue usada para determinar materia seca (MS) mediante secado en horno (marca MRC de la serie DNI-50) a 60°C con pesajes cada 24 horas hasta obtener peso constante y luego fue sometido al análisis bromatológico mediante las técnicas analíticas convencionales de la AOAC (AOAC, 1999) (MS método ID 934.01, proteína bruta método ID 984.13 y fibra detergente neutro (Van Soest et al., 1991).
Tratamientos: los tratamientos estuvieron determinados por el forraje y la proporción de aceite de girasol: 1% y 3% de la MS o sin adición, así:
1. Kikuyo (Pennisetum clandestinum) sin aceite 2. Kikuyo (Pennisetum clandestinum) con 1% de aceite de girasol 3. Kikuyo (Pennisetum clandestinum) con 3% de aceite de girasol 4. Ryegrass (Lollium perenne) sin aceite 5. Ryegrass (Lollium perenne) con 1% de aceite de girasol 6. Ryegrass (Lollium perenne) con 3% de aceite de girasol
El aceite de girasol comercial se mezcló con los forrajes 24 h antes del inicio de la fermentación. Luego se puso el substrato de fermentación (0,5 g de MS) dentro de botellas (FIC-5 de 100 ml) previamente rotuladas, que fueron almacenadas a -4ºC hasta iniciar la inoculación. Las botellas se prepararon por cuadruplicado: dos de estas botellas se incubaron por 144 horas para determinar la cinética de fermentación, las otras dos botellas se incubaron por espacio de 24 horas para determinar el perfil de ácidos grasos de cadena larga (AGCL) y los ácidos grasos volátiles (AGV).
Diseño experimental y análisis estadístico: El diseño experimental utilizado fue el completamente al azar con arreglo factorial 2 x 3 (dos pastos y tres niveles de adición de aceite: 0, 1 y 3% de la MS).
El modelo de análisis estadístico fue el siguiente:
yijk = µ + αi + βj + αβ(ij) + εijk,
donde yijk es cada observación individual, µ es la media, αi es el efecto del factor pasto (Kikuyo o Ryegrass), βj es el efecto del nivel de inclusión de aceite, αβ(ij) es la interacción entre ambos factores y εijk es la varianza o error residual.
Fuente del inóculo de fermentación: la fuente del inóculo de fermentación (líquido ruminal) se obtuvo de dos bovinos cebú provistos de una cánula ruminal (Preston, 1995) y pastoreando una pradera de Kikuyo y Ryegrass (75% y 25%), solo se suplementó con sal mineralizada. El inóculo se obtuvo en horas de la mañana (rumen lleno) mediante la extracción manual del material pastoso presente en la porción ventral caudal y ventral craneal de la cavidad ruminal, dicho material se filtró usando gasa aséptica y se recogió el líquido resultante en recipientes isotérmicos de 2 L para su trasladado al laboratorio.
En laboratorio, el líquido ruminal se filtró una vez más, se dispuso en vasos de precipitado (1 L) y se mantuvo a 39°C y gaseado con CO2 hasta el momento de la inoculación.
Medio de cultivo: la preparación del medio de cultivo se hizo utilizando una mezcla de diluciones de macrominerales y microminerales, dilución buffer, dilución reductora y resazurina en un medio anaerobio conseguido mediante la saturación de la mezcla con CO2 (Menke & Steingass, 1988).
La dilución de macrominerales se preparó con 4,2 g de fosfato de sodio anhidro (Na2HPO4- Lab. CARLO ERBA), 4,6 g de fosfato de potasio anhidro (KH2PO4 – Lab. CARLO ERBA) y 0,4 g de sulfato de magnesio (MgSO4 7H2O – Lab. CARLO ERBA) en 741,1 ml de agua destilada. La dilución de microminerales estuvo compuesta por 0,049 g de cloruro de calcio (CaCl2 2H2O – Lab. CARLO ERBA), 0,037 g de cloruro de manganeso (MnCl2 2H2O – Lab. MERCK), 0,004 g de cloruro de cobalto (CoCl2 6H2O – Lab. SCHARLAU) y 0,030 g de cloruro de hierro (FeCl3 6H2O – Lab. MERCK) en 3,7 ml de agua destilada.
La solución buffer fue preparada a partir de 0,004 g de carbonato de amonio ((NH4) HCO3 – Lab. CARLO ERBA), y 0,218 g de bicarbonato de sodio (NaHCO3 – Lab. CARLO ERBA) en 741 ml de agua destilada. La resazurina se mezcló a razón de 0,004 g (C12H6NNaO4 – Lab. PANREAC) con 3,7 ml de agua destilada.
Finalmente se elaboró la dilución reductora, compuesta de 0,926 g de hidrocloruro de cisteína (C3H8CINO2S*H2O – Lab. MERCK), 5,929 ml de hidróxido de sodio (1N) (NaOH – Lab. CARLO ERBA) y 0,926 g de sulfuro de sodio (Na2S9H2O- Lab. CARLO ERBA) en 148,2 ml de agua destilada. Para su preparación se usó una botella de vidrio de 5 L puesta sobre una placa de calentamiento a 39°C con agitación magnética (WISD – MSH-20D) y sometida a gaseado con CO2.
Luego de tener la solución reductora homogenizada y a 39°C, se adicionaron los macrominerales, microminerales, resazurina y dilución buffer; y se mantuvo en la placa de calentamiento con agitación y gaseado con CO2 hasta que el medio de cultivo tomó un color rosado brillante que indica su saturación con el gas (aprox. 2 h).
Inoculación: poco antes de la incubación los frascos con substrato se precalentaron a 39°C usando la incubadora. Luego mediante el uso de una jeringa a cada frasco se le adicionó 40 ml de medio de cultivo y 10 ml de líquido ruminal, se gaseó con CO2 y luego se selló con el tapón de caucho y el agrafe de aluminio. Después se picharon las botellas (aguja calibre 20 de 1 pulgada), para equilibrar las presiones interna y externa, se agitaron con suavidad y se ubicaron en bandejas metálicas dentro de la incubadora (39°C).
Muestreos: como se mencionó, dos de las botellas preparadas por cuadruplicado se incubaron por 144 horas, a éstas se les realizó un seguimiento de la producción de gas y de la presión (PSI) a las 3, 6, 9, 12, 16, 20, 24, 29, 34, 44, 56, 68, 83, 98, 120 y 144 horas post incubación. En cada ocasión se registró la hora de inicio y de finalización de la medición. Para la medición de presión se usó un equipo DELTA -2304-0, equipado con una sonda de presión relativa DTP-704-2BGI, que se acopló a una llave de tres vías a la cual también se acoplaron una aguja (referencia 20G de 1 pulgada), para pinchar a través de los tapones de los frascos y obtener la lectura de la presión, y una jeringa de (20 ml) de para extraer el gas y determinar su volumen. El gas obtenido en cada lectura se fue depositando dentro de bolsas herméticas hasta la lectura de 48 h, momento en que se tomó una muestra de gas (12 ml) y se depositó en tubos de 10 ml con vacío (VACUETTE) hasta la realización del análisis de CH4. Luego de obtener las lecturas de presión y volumen de gas, las botellas se agitaron y luego se regresaron a la incubadora hasta la siguiente lectura.
Con la segunda pareja de botellas preparadas por cuadruplicado se siguió este mismo procedimiento para la lectura de presión y obtención de gas, pero solo durante las primeras 24 h de incubación. En ese momento las botellas fueron destapadas para obtener una muestra de su contenido (40 ml), que se depositó en tubos FALCON (marca Fisher Brand) de 50 ml, donde se mantuvo hasta la realización del análisis de ácidos grasos de cadena larga (AGCL, incluidos ALC y ATV). También se obtuvo una muestra de 3 ml de contenido de cada botella que se depositó en tubos de ensayo de 6 ml (VACUETTE) y se usó para el análisis de ácidos grasos volátiles (AGV). Tanto las muestras para análisis de AGCL como las muestras para AGV se conservaron a -20°C; las muestras de gas se conservaron a temperatura ambiente.
Determinación de la cinética de producción de gas: se hizo a partir de los datos de producción acumulada de gas previa corrección por blancos y tiempo de incubación, los datos se ajustaron (individualmente para cada botella) al modelo exponencial:
G = A (1-e-c (t-L))
donde:
“G” es la producción acumulada de gas (ml) “A” es la producción de gas a partir de la fermentación (ml) “c” es la tasa de producción de gas “L” (Lag) es el tiempo en horas antes de iniciar la producción de gas. Para el ajuste de las curvas de producción de gas se utilizó el programa SAS.
Determinación de metano: en las muestras de gas se determinó la concentración de CH4 mediante cromatografía de gases, para ello se usaron una columna STABILWAX-DA con límites de temperatura: 40 a 240/250°C longitud: 30 m ID: 0,53 mm df (µm): 1.00 µm, marca RESTEK; y un detector de ionización de llama FID Marca Agilent HP modelo 3890, el gas de arrastre (helio) tuvo un flujo de 24 ml/min. El contenido de CH4 se determinó mediante calibración externa, usando una mezcla de gases certificada. Las pruebas se desarrollaron usando un equipo de cromatografía de gases-masas marca Shimadzu GC Modelo 2010, con un inyector Shimadzu AOC – 20i y un espectrómetro Shimadzu GCMSQP2010.
Determinación de ácidos grasos de cadena larga: para el análisis de ácidos grasos de cadena larga del líquido ruminal, se llevaron a cabo los siguientes procedimientos:
1. Extracción: luego de liofilizar 40 ml de la muestra de líquido ruminal se tomaron 500 mg, se sometieron a extracción utilizando cloroformo y metanol (2:1) (Bligh & Dyer, 1959) y se obtuvieron los ácidos grasos utilizando un rotavapor. 2. Derivatización: la volatilización de los ácidos grasos (formación de su metiléster), necesaria para su análisis mediante cromatografía de gases, se hizo utilizando trifluoro de boro en metanol (ácido de Lewis) (Christie, 1990). 3. Cromatografía de gases: el análisis de AGCL se realizó por cromatografía de gases acoplado a espectrometría de masas, empleando una columna CP-Sil 88 de 100 m. La identificación de los AGCL se hizo utilizando el estándar FAME mix 37 de Supelco y los estándares en forma ácida de ALC y ATV (Gomez-Cortes et al., 2008).
Determinación de ácidos grasos volátiles (AGV): para hacer la determinación de AGV (acético, propiónico, butírico), se empleó un total de 0,8 ml de la muestra de líquido ruminal dispuesta para ello; se preparó para un análisis de cromatografía de gases, mediante la adición de 0,5 ml de una solución con 20 g/L de ácido metafosfórico y 4 g/L de ácido crotónico (usado como estándar interno) en ácido clorhídrico 0,5 N. Adicionalmente, se usó un estándar externo con los ácidos: acético, propiónico, butírico, isobutírico, pentanoico, isopentanoico y hexanoico, este se usó como patrón externo con el cual se estableció la curva de calibración de cada AGV. El análisis se hizo usando cromatografía de gases con detector FID con una columna semicapilar, TR-FFAP, 30 m × 0,53 mm × 1 m (Supelco, USA) (García-González et al., 2008).
Resultados y Discusión
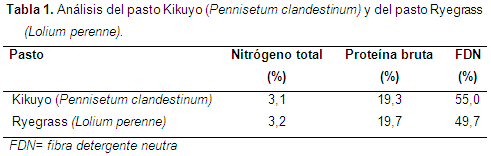
Contenido de PB y FDN en los pastos: el pasto Kikuyo presentó niveles de proteína bruta (PB) de 19,4% y de fibra detergente neutra (FDN) de 55%, correspondiéndose con la literatura, donde se registran valores de PB de 15,4% a 27,1% y de FDN de 51,7% a 66,9% (Correa et al., 2009). El Ryegrass tuvo PB de 19,7% y FDN de 49,7%, valores ligeramente superiores a los presentados por Estrada (2002), quien registra valores de PB y FDN de 16,9% y 45,7%, respectivamente (Tabla 1).
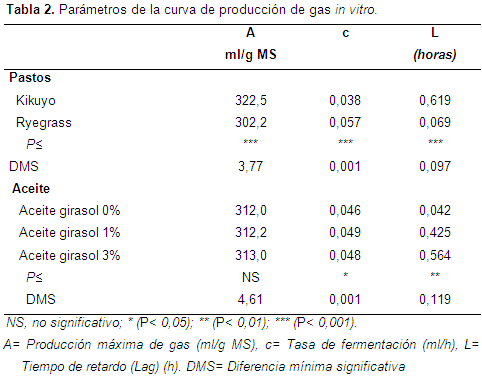
Cinética de fermentación: Los parámetros de la cinética de producción de gas se presentan en la Tabla 2. En el caso de los pastos, se observaron diferencias significativas (P<0,001) para todas las variables: producción máxima de gas (A), tasa de fermentación (c) y tiempo de retardo (L). El pasto Kikuyo fue el forraje de mayor producción acumulada de gas (A). Una elevada producción de gas está asociada principalmente a un alto contenido de proteína bruta, un moderado contenido de FDN (inferior al 60%) y una baja proporción de lignina (Sánchez et al., 2005) (Li & Meng, 2006). Sin embargo, el Kikuyo tuvo menor tasa de fermentación (c) lo cual puede estar asociado a su mayor contenido de FDN, y a una correspondiente y eventual menor proporción de carbohidratos no estructurales (CNE) de fácil fermentación (Sánchez, Arreaza & Abadía, 2005); se ha registrado que el pasto Kikuyo contiene 13,4% de CNE, que frente a 22% de pastos como el Brachiaria decumbens, le hacen un sustrato de más lenta tasa de fermentación (Correa, Pabón & Carulla, 2009). Contrario a lo esperado dada su calidad, con un contenido de FDN inferior al pasto Kikuyo, el pasto Ryegrass produjo menos gas. Sin embargo, su tasa de fermentación fue notablemente mayor (0,057 vs 0,038) y tuvo menor tiempo de demora antes del inicio de la degradación. Lo que podría indicar que en esta pastura la colonización bacteriana del substrato es más eficiente.
Respecto a la adición de aceite de girasol, no se observaron diferencias entre los tres niveles de inclusión (0%, 1% y 3%) en cuanto a la variable de producción de gas (A), es decir que la adición de aceite no afectó negativamente la fermentación. Lo cual corresponde con el hecho que el efecto negativo de las grasas sobre la fermentación depende del tipo de grasa y con niveles de grasa superiores al 6% MS de dieta (Broudiscou et al., 1994). Hervás et al. (2001), tampoco observaron in vitro efecto negativo de bajos niveles de suplementación lipídica (1 y 2%) e incluso observaron aumento con el 2% de adición de aceite. Por otro lado, la adición de aceite sí alteró (P<0,05) la tasa de producción de gas(c): fue mayor con el 1% de aceite de girasol, seguido por el de 3% de aceite y menor en el control sin aceite; Hervás et al. (2001) también observaron alteración de la tasa de producción de gas debido a la adición de aceite (34,5 ml/h, 30,6 ml/h y 40,3 ml/h con niveles de adición de 0,150 y 300 mililitros de grasa en 14 gramos de pasto). Al mismo tiempo se observó un aumento significativo (P<0,001) en el tiempo de demora para el inicio de la producción de gas: la adición de aceite hizo que la demora pasara de 0,04 h a 0,42 h y 0,56 h con la adición de aceite al 1 y 3%, respectivamente, efecto que también ha sido registrado con anterioridad (Arenas et al., 2010; Patra & Yu, 2013).
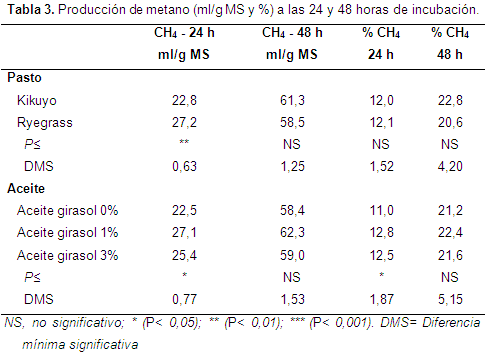
Producción de metano (CH4): la producción total y el porcentaje de CH4 en relación al gas producido a 24 y 48 horas de fermentación in vitro se muestran en la Tabla 3. Solo se observaron diferencias significativas (P<0,01) en la producción y en el porcentaje de CH4 a las 24 h postincubación. En este tiempo, el pasto Ryegrass produjo mayor cantidad de metano (27,2 ml/g MS) que el pasto Kikuyo, pero ambos pastos tuvieron igual concentración de CH4; por lo tanto, la mayor producción de metano del pasto Ryegrass a las 24 horas de incubación estuvo determinada por su considerablemente mayor tasa de producción gas que la del pasto Kikuyo, que determina a su vez una mayor producción de gas total a las 24 horas de incubación. Sin embargo, se ha estimado que las gramíneas C4 (Kikuyo) producen más metano (hasta 14,3%) por unidad de energía digestible que las especies de clase C3 (Ryegrass) y esto se atribuye a una mayor proporción de celulosa y lignina en las primeras (Vargas et al., 2012).
Por otra parte y contrario a lo esperado, la adición de niveles del 1 y 3% de aceite de girasol incrementó ligeramente la producción (22,5, 27,1 y 25,4 ml/g MS para 0% 1% y 3% de aceite, respectivamente) y la concentración de CH4 (11, 12,8 y 12,5% para 0% 1% y 3% de aceite, respectivamente). La adición de lípidos puede reducir la emisión deCH4 ruminal, disminuyendo: la cantidad de materia orgánica fermentada en el rumen, la actividad de las bacterias metanogénicas o el número de protozoos (Cieslak et al., 2013; Patra & Yu, 2013); y a través del uso de hidrógeno durante el proceso de biohidrogenación (Johnson & Johnson, 1995), pudiendo alcanzar hasta un 50% de reducción (Machmüller et al., 1998). Efectivamente, contrario a lo encontrado en este trabajo se han registrado reducciones substanciales en la producción de CH4 a través de la suplementación de aceites, especialmente aceites ricos en ácidos grasos de cadena media (≤C:14) y de cadena larga (>C:14) (Fievez et al., 2003; Jordan et al., 2006). La suplementación con ácidos grasos de cadena larga (C:18) ha generado efectos antimetanogénicos (Jalc et al., 2007; Beauchemin et al., 2009). Sin embargo, Cosgrove et al. (2008) encontraron que la infusión de aceites al rumen en concentraciones inferiores al 5% no afectó la producción de CH4. Incluso con niveles de hasta 10% de suplementación de aceite de girasol en la dieta, solo se ha observado una ligera disminución en la producción de CH4 (Soder et al., 2013).
En términos generales, el porcentaje de CH4 a las 48 h es 1,8 veces mayor que a las 24 h de incubación; según Abrego (2012) en los sistemas de cultivo cerrado siempre hay un nutriente esencial que se agota a través del tiempo y entonces se altera la fermentación y acumulación de los productos de desecho; tras la hidrólisis de los polímeros del sustrato las bacterias utilizan casi todo el hidrógeno en la producción de CH4, lo que indica dominio de las bacterias metanogénicas en el ecosistema ruminal (Chaucheyras-Durand et al., 2010).
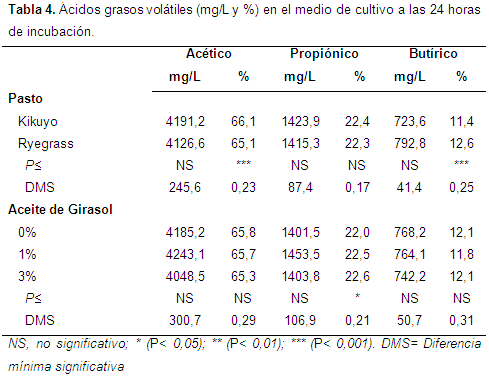
Ácidos grasos volátiles (AGV): la concentración de los ácidos grasos volátiles se presenta en la Tabla 4. Respecto al nivel de adición de aceite, no se observaron diferencias en las concentraciones (mg/L) de AGV; sin embargo, se detectaron ligeras diferencias en la proporción de ácido propiónico entre los tratamiento con y sin aceite. Otros trabajos han mostrado que la utilización de diversos aceites (coco, girasol, pescado y almendras) no ha afectado las proporciones de AGV, aunque sí es posible ver cambios en la relación acético/propiónico (Panyakaew et al., 2013).
Respecto a la pastura, se encontró que el Kikuyo genera una proporción de acético ligeramente mayor (66,1% vs 65,1%), lo cual corresponde con un mayor contenido de FDN (Correa, Pabón & Carulla, 2009); en contraste, el Ryegrass produjo un nivel superior de butírico (12,6% vs 11,4%), efecto que también fue observado por Hervás et al. (2001). El aumento en la producción de CH4 está generalmente acompañado de un aumento en la relación acético-propiónico (McAllister & Newbold, 2008; Lila et al., 2005; Russell, 1998); en el presente estudio aunque la producción de CH4 a las 24 h fue diferente entre las pasturas, la relación acético/propiónico fue similar.
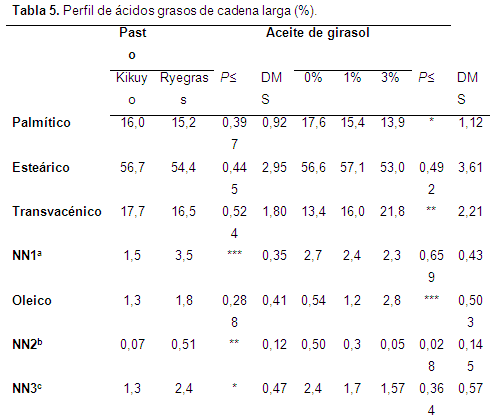
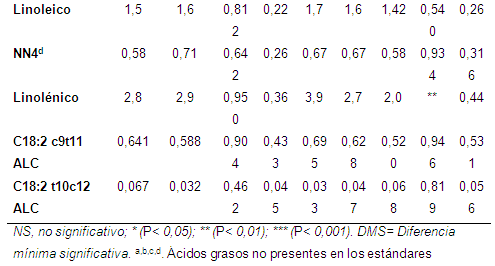
Ácidos grasos de cadena larga (AGCL): la proporción de ácidos grasos de cadena larga en la digesta (postincubación) se muestra en la Tabla 5. La inclusión de niveles cada vez mayores de aceite de girasol generó un aumento significativo (P<0,01) en la proporción ATV en la digesta. Con una inclusión de 3% de aceite de girasol el ATV alcanzó una proporción de 21,8%; incluso la adición de 1% de aceite de girasol aumentó la proporción de ATV, pero en menor medida (16%, vs 13,45 en el control), lo que corresponde con el efecto normalmente esperado (Khanal & Dhiman, 2004; Jayanegara et al., 2012). No se registraron efectos de la adición de aceite sobre la concentración de ALC; sin embargo, el notorio efecto observado sobre la proporción de ATV que se presentó como consecuencia de la adición de aceite y el hecho que gran parte del isómero ALC presente en la leche es sintetizado a partir del ATV formado en el rumen (Bauman et al., 2000), permite pensar que la metodología empleada es apropiada para evaluar el potencial de diferentes fuentes y niveles de suplementación lipídica sobre la producción de ATV a nivel ruminal, en perspectiva de mejorar los niveles de ALC en la carne y la leche de los rumiantes, como se ha observado en estudios in vivo (AbuGhazaleh (2008).
La adición de aceite de girasol también alteró la proporción de los ácidos: palmítico (P<0,05), oleico (P<0,001) y linolénico (P<0,01): aumentó la proporción relativa del ácido oleico y al mismo tiempo disminuyó la proporción de los ácidos palmítico, linoleico y linolénico. En relación con las pasturas, no se observaron diferencias en las proporciones de ATV o ALC, ni en los ácidos palmítico, esteárico, oleico, linoleico y linolénico.
Conclusiones
La inclusión de aceite de girasol en el sustrato de fermentación (pasturas de trópico frío) aumentó notoria y significativamente la proporción relativa de ATV, pero no afectó la de ALC. El efecto sobre el ATV fue mayor con la adición de 3% de aceite. Excepto un leve aumento en el tiempo de inicio de la producción gas, la adición de aceite no tuvo un efecto negativo sobre la fermentación: tasa y producción de gas ni sobre la proporción de AGV. La adición de aceites también aumentó la proporción de ácido oleico, pero disminuyó las proporciones de los ácidos palmítico, linoleico y linolénico. La tasa de producción de gas fue mayor en el pasto Ryegrass que en el pasto Kikuyo, pero la producción de gas total fue mayor en el último.
Referencias bibliográficas
Cómo citar: Vélez-Ruiz, J.P.; Tequin-Ocampo, E.B.; Vargas-Sánchez, J.E. Efecto in vitro del aceite de girasol (Helianthus annuus L.) sobre ácido transvacénico y patrón de ácidos grasos de cadena larga en la digesta ruminal. Revista Veterinaria y Zootecnia, v. 11, n. 1, p. XX-XX. DOI: 10.17151/vetzo.2017.11.1.4 |