|
Leptospirosis en Bull terrier. Reporte de caso
ARTÍCULO CORTO
Daniel Uribe-Castillo
1Universidad de Caldas, Facultad de Ciencias Agropecuarias, Manizales, Colombia.
(Recibido: 9 de mayo de 2016 Aprobado: 15 de junio de 2016 Actualizado: Noviembre 08 de 2016)
This email address is being protected from spambots. You need JavaScript enabled to view it.
DOI: 10.17151/vetzo.2016.10.1.8
RESUMEN: La leptospirosis es una enfermedad zoonótica causada por la infección con cualquiera de los más de 250 serovares de una bacteria Gram negativa con forma de espiral llamada Leptospira. La leptospirosis en perros fue descrita por primera vez en 1899 y recientemente ha recibido atención como causa importante de enfermedad hepática y renal. La enfermedad en los perros puede ser aguda, crónica o subaguda; la presentación más frecuente es la infección aguda, que se caracteriza por la presencia de anemia, ictericia, diarrea, fiebre y deshidratación, afectando a los sistemas renal y hepático. El tratamiento en perros se enfoca en evitar daños irreparables causados por la Leptospira, pero no garantiza que el paciente se recupere por completo y es por eso que la vacunación juega un papel importante en la prevención de enfermedades. El presente artículo tiene como objetivo analizar y discutir un caso clínico de la condición, su curso y enfoque diagnóstico y terapéutico.
Palabras clave: leptospirosis, ictericia, infección aguda, serovar, zoonótica
Leptospirosis in a Bull terrier. Case Report
ABSTRACT: Leptospirosis is a zoonotic disease caused by infection with any of the more than 250 serovars of a corkscrew-shaped gram negative bacteria called Leptospira. Leptospirosis in dogs was first described in 1899 and has recently received attention as a cause of hepatic and renal disease. The disease in dogs can be acute, chronic or subacute, being the most frequent acute infection which is characterized by the presence of anemia, jaundice, diarrhea, fever and dehydration affecting the renal and hepatic systems. The treatment in dogs focuses in avoiding irreparable damage caused by Leptospira, but does not guarantee that the patient recovers completely and that is why vaccination plays an important role in disease prevention. This article aims to analyze and discuss a clinical case of the condition, its course and diagnostic and therapeutic approach.
Key words: acute infection, jaundice, leptospirosis, serovar, zoonotic
Leptospirose em um Bull terrier. Relatório de caso
RESUMO: A Leptospirose é uma doença zoonótica causada por uma infecção com qualquer dos mais de 250 serotipos de uma gamma de bactérias espiroquetas Gram negativas chamadas Leptospira spp. A leptospirose nos cães foi descrita em 1899 e recebeu recentemente a atenção como de presentação subaguda, aguda ou crônica, com maior freqüência de presentação da infecção aguda; nesta é caracterizada pela presença de anemia, icterícia, diarreia, febre, desidratação uma nova causa de doença hepática e renal. A doença nos cães pode ser, afetando mais os sistemas renal e hepático. O tratamento em cães é para evitar danos irreparáveis provocados pela bactéria, mas não é garante que o paciente tenha uma recuperação completa, por isso a vacinação desempenha um papel importante na prevenção da doença. Este artigo tem por objetivo analisar e discutir um caso da doença, seu curso e abordagem diagnóstica e terapêutica.
Palavras-chave: leptospirose, ictericia, infecção aguda, sorotipo, zoonótica
Introducción
La leptospirosis es una enfermedad zoonótica causada por la infección con uno de los más de 250 serovares de una bacteria Gram negativa en forma de espiral de la clase de las Spirochaetes llamada Leptospira. Esta patología se encuentra distribuida mundialmente y es considerada como una de las enfermedades zoonóticas de mayor prevalencia global (Macedo et al., 2007). Romero et al. (2010), evidenciaron una prevalencia del 21,4% en caninos (portadores de al menos un serovar), en regiones de Tolima, Colombia. En humanos la prevalencia fue del 6%. En Colombia se desconoce la epidemiología exacta de la leptospirosis en ambientes urbanos y el papel del canino en el ciclo de transmisión en dichos ambientes no es claro; aun así, hay algunos factores específicos que han sido identificados en su transmisión, como la deficiencia en los servicios sanitarios básicos, el inadecuado manejo de basuras, la presencia de aguas estancadas y el contacto con roedores (Rodríguez et al., 2005).
La leptospirosis en perros se describió por primera vez en 1899 y recientemente recibió atención debido a que es una causa importante de enfermedad renal y hepática (Bolin, 2002). Los principales reservorios de la Leptospira en el ambiente urbano son los caninos y los roedores, así como los bovinos, porcinos y equinos en el campo. De los roedores como animales silvestres en ámbitos urbanos se pueden mencionar las especies Rattus rattus, (rata negra), Mus musculus (ratón) y Rattus norvegicus (rata de alcantarilla). La Leptospira se adaptó además a huéspedes reservorios, los cuales comúnmente son animales salvajes que hacen más difícil su control y aumentan la prevalencia de esta enfermedad. La infección en humanos y animales se da por contacto directo con orina infectada, fluidos fetales y placentarios, descargas uterinas o por contacto con el ambiente contaminado (Berdasquera & Cruz, 2009).
La enfermedad en caninos puede tener un curso agudo, subagudo o crónico, presentándose con mayor frecuencia la infección aguda; que se caracteriza por la presencia de anemia, ictericia, diarrea, fiebre y deshidratación, afectando en mayor proporción a los sistemas renal y hepático (Cano, 2012). El número de casos de leptospirosis canina se ha incrementado de manera dramática en los últimos años, representando una causa relevante de morbilidad y mortalidad en dicha población.
El diagnóstico clínico se basa en la epidemiología, anamnesis y signos clínicos; siendo estos muy inespecíficos, pudiéndolos asociar con otras patologías como enfermedad por parásitos cardiacos (dirofilariosis), anemia hemolítica autoinmune, hepatitis viral canina, neoplasia hepática, trauma, ehrlichiosis, toxoplasmosis, neoplasia renal, cálculos renales, entre otros (Cano, 2012). El aislamiento de la Leptospira es la mejor alternativa para diagnosticar la enfermedad (Valverde et al., 2008).
El tratamiento en caninos se maneja de forma sintomática para evitar los daños irreparables causados por las Leptospiras, aunque no garantiza que el paciente se recupere en su totalidad y es por esto que la vacunación juega un papel relevante en la prevención de la enfermedad, la vacuna dispone de bacterinas inactivadas bivalentes que contienen dos serovares (L. canicola y L. icterohaemorragiae). Existen numerosas firmas comerciales que se dedican a la producción de vacunas contra los serogrupos de Leptospira de más alta incidencia, combinadas con vacunas virales tales como parvovirus, distemper canino, hepatitis canina y rabia (Musacchio et al., 2010).El tratamiento debe iniciarse a la menor sospecha, ya que de no ser así, suele fracasar por la gravedad de la enfermedad y debido a las lesiones hepáticas y renales. Consiste en la terapéutica sintomática y la administración de antibióticos que permitirá mantener al paciente en el mejor estado posible y eliminar al agente infeccioso. Se preferirá para la medicación la vía parenteral a la oral, debido a la emésis que acompaña a la enfermedad (Wohl, 1966).
Evaluación del paciente
Anamnesis
Un canino hembra, Bull terrier de 6 años y 6 meses de edad, 21,6 kg de peso y condición corporal 3/5 se presentó a la Clínica Veterinaria el Poblado, con historia de consumo de materiales extraños procedentes de sitios concurridos por roedores, la paciente presentaba signos de letargo, varios episodios de emesis de característica alimenticio, presentaba además inapetencia. El propietario además reportó que su mascota no contaba con el plan vacunal completo, solamente había sido vacunada en una ocasión durante su etapa de cachorra con un producto desconocido y nunca fue revacunada, el propietario además había notado presencia de ectoparásitos (garrapatas) recientemente.
Hallazgos clínicos
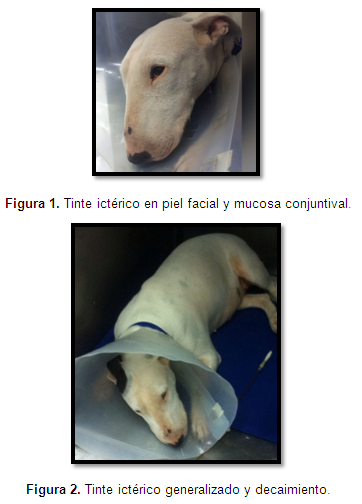
Al examen clínico se apreció la paciente deprimida pero respondiendo a estímulos externos. La paciente presentaba fiebre (40°C), su patrón respiratorio era eupnéico, y su frecuencia cardiaca también se encontró dentro de lo normal, a la auscultación cardiopulmonar los sonidos estaban normales. En la evaluación física se evidenció la mucosa gingival, escleral y la piel de las regiones abdominal, inguinal, axilar y perineal con marcado tinte ictérico (Figuras 1 y 2). Su tiempo de llenado capilar estaba en 1 segundo, no había signos aparentes de deshidratación. Los linfonodos se hallaron normales a la palpación. Y su pulso femoral estaba fuerte y concordante. A la palpación abdominal no se encontró molestia ni distención. La paciente fue trasladada al área de hospitalización para iniciar fluidoterapia a razón de mantenimiento y para realizar aproximaciones diagnósticas, la recomendación a la hora de la hospitalización es que su manipulación fuese con guantes.
Resultados
Ayudas diagnósticas
Se tomaron exámenes sanguíneos de hemograma, alanino aminotransferasa (ALT), albúmina y creatinina al primer día de hospitalización y transcurridos cuatro días. En el primer hemograma la única línea alterada fueron las plaquetas, la paciente presentó trombocitopenia con plaquetas en 154.000 Pl/µl (valores de referencia 200.000–500.000). La trombocitopenia es un signo que puede o no estar presente en la enfermedad (Luna et al., 2008). La albumina y la creatinina estuvieron dentro de los rangos normales, y la ALT representó el valor más alterado en los primeros exámenes, tuvo un resultado de 1.431 U/L, los valores de referencia son de 15-60 U/L aunque el rango de normalidad varía según laboratorios (García & Zurita, 2005). La ALT es una enzima de ubicación citoplasmática del hígado. Su aumento está asociado a procesos inflamatorios (reversibles) hepáticos y también a procesos de necrosis.
Una discreta elevación de las transaminasas hepáticas es en ocasiones el único dato que orienta la presencia de una hepatopatía en un paciente asintomático; sin embargo, este hallazgo nada informará acerca de la gravedad o etiología de la enfermedad hepática. Cuando la alanina aminotransferasa (ALT) está elevada 10 o más veces del límite superior de referencia puede diagnosticarse la existencia de lesión hepática aguda y en estos casos debe iniciarse de inmediato el estudio etiológico (Dufour et al., 2000; Craxi & Amasio, 1996).
Se le realizó además una prueba rápida de hemoparásitos debido a que la paciente presentó historial de ectoparásitos, se realizó test para detección de Antígenos (Ag) de Dirofilaria immitis, Anticuerpos (Ac) contra Anaplasma platys-phagocytophilum, Ac Borrelia burgdorferi, Ac Erlichia canis-ewingii (Test SNAP 4Dx, IDEXX Laboratories, Inc., Westbrook, Maine, US), la prueba tiene una especificidad del 100% y una sensibilidad de entre el 96,2% al 99,2% según el hemoparásito (Courney & Zeng, 2001), el resultado para esta prueba fue negativo.
Al segundo día de hospitalización se tomó muestra para examen de bilirrubina directa y total mediante la técnica de enzimática colorimétrica, el resultado fue 9,56 mg/dl (valores de referencia 0,06-0,12), y 13,98 mg/dl (valores de referencia 0,1-0,3) respectivamente. Aproximadamente, el 15% de animales con leptospirosis presentan bilirrubinemia mayor a 2 mg/dl, debido a degeneración obstructiva hepatocelular y la colestasis intrahepática y no a la hemólisis como suele pensarse (Luna et al., 2008).
Debido a los hallazgos de laboratorio acompañados de los signos clínicos de la paciente, se decidió realizar un prueba rápida de Leptospira mediante test ImmunoComb ELISA kit (Biogal-Galed Laboratories, Israel), el resultado fue S2 y los valores para interpretación son: S0: reacción negativa a Leptospira, >S5 reacción positiva alta a Leptospira, S1-2 reacción positiva baja a Leptospira y >=S3 reacción positiva a Leptospira.
Debido al resultado decide tomarse muestra para serología por microaglutinación para Leptospira, la cual es considerada por la Organización Panamericana de la Salud (OPS) y la Organización Internacional de Epizootias (OIE) como la prueba de mayor validez diagnóstica para la enfermedad (Goris & Hartskeerl, 2014; Cano, 2012).
La prueba de aglutinación microscópica (MAT) se lleva a cabo mediante la incubación del suero de paciente con varios serovares de Leptospiras. Los títulos se obtienen mediante pruebas de varias diluciones de suero con el serotipo positivo. El serovar que reacciona con el suero del paciente se sugiere que es el serovar infectante (Chirathaworn et al., 2014). La prueba identifica resultados para 8 serovares, y arrojó positivo para Leptospira Patoc y Hardjo, los resultados pueden apreciarse en la tabla 1.
Los criterios de interpretación de la prueba indican que títulos de 1:50 son sospechosos y de 1:100 o mayores, son positivos. Títulos de 1:100 a 1:200 son de importancia principalmente en animales no vacunados, títulos mayores con una sola muestra (=1:800) son usualmente indicativos de infección y son de valor diagnóstico siempre y cuando existan datos compatibles con el cuadro clínico (Srivastava, 2010).
Posterior al diagnóstico positivo de leptospirosis se decidió realizar hemograma, ALT, albumina y creatinina de control, en el hemograma el hematocrito se encontró en 37,8% (valores de referencia: 39,2-58,8%), presentó hemoglobina en 12 g/dl (valores de referencia: 12,7-16,3 g/dl), las plaquetas estaban en 197.000, y además la paciente presentó leucocitosis de 21.400 Leu/µl (valores de referencia: 6.000-15.000 Leu/µl). Se ha reportado leucocitosis moderada posterior a los cuatro a cinco días de la enfermedad al igual que hemoglobina baja y anemia regenerativa de moderada a severa (Luna et al., 2008). La ALT disminuyó a 436 U/L, la albumina y la creatinina permanecieron dentro de los rangos normales.
Enfoque terapéutico
La paciente se hospitalizó en el área de cuidados intermedios, se instauró fluidoterapia de reposición con Lactato de Ringer a dosis de mantenimiento. Se inició tratamiento con oxitetraciclina a dosis de 10 mg/kg/IV BID (Genfar S.A) debido a la sospecha inicial de presencia de hemoparásitos, posterior al resultado negativo en el test rápido de hemoparásitos se decide suspenderla. Hicieron parte del plan terapéutico intrahospitalario los siguientes medicamentos: dipirona manejada a dosis de 28 mg/kg/IV BID (Colivet, laboratorios Provet, Bogotá, Colombia), instaurada como antipirético, omeprazol a 0,7 mg/kg/IV BID (Vitalis pharmaceutical, Bogotá, Colombia) y ranitidina a 2mg/kg/SC BID (Vitalis pharmaceutical, Bogotá, Colombia), se emplearon como protectores gástricos a causa del historial de consumo de objetos extraños y la emesis, la piridoxina a dosis de 15mg/kg/IV BID (Metadoxil, Eurodrug Laboratories, Bogotá, Colombia) y el ácido ursodesoxicólico (Ursacol, Zambon S.A, Bogotá, Colombia) fueron utilizados como protectores hepáticos. Posterior a los resultados de laboratorio se anexó metronidazol a la medicación a dosis de 20 mg/kg/IV BID (Tenaflox, Laboratorios Claris, Bogotá, Colombia) a razón de la leucocitosis moderada. La metoclopramida a 0,5 mg/kg/SC BID (Vitalis pharmaceutical, Bogotá, Colombia) y citrato de maropitant a 1 mg/kg/SC (Cerenia, laboratorio Zoetis, Bogotá, Colombia), se incluyeron dentro de la medicación como antieméticos.
La fórmula de salida de la paciente fue: conjugado de penicilina procaínica, penicilina sódica, estreptomicina y triamcinolona a razón de 1 ml por cada 20 kg de peso (Veta-Dicrysticina Novartis de Colombia S.A), ácido ursodesoxicólico a dosis de 10mg/kg/PO SID (Ursacol), astraglosidos un sobre del preparado al día (Remphys de laboratorio Biotech), omeprazol y metoclopramida a las dosis previamente instauradas.
Durante la hospitalización se decidió ubicar sonda urinaria a la paciente con el fin de controlar el depósito de orina, puesto que se sospechaba de enfermedad infectocontagiosa. Conforme fue transcurriendo la estancia hospitalaria la paciente se apreciaba más dinámica, recibía con agrado el alimento ofrecido. Se instauró medicación por vía enteral, lo cual toleró de manera adecuada, en el momento que llegó el resultado confirmatorio para leptospirosis, se instauró nuevo plan terapéutico basado en penicilina y estreptomicina; la paciente tras cuatro días de estancia recuperó el ánimo, se encontraba dinámica y no presentaba inapetencia, los propietarios deciden llevársela con el tratamiento en casa, y aceptando todas las recomendaciones de estricto cumplimiento indicadas con el fin de prevenir el riesgo zoonótico de la enfermedad.
Tras completar el tratamiento instaurado y según el reporte por parte de los propietarios 4 meses después a la alta médica, se informó que la paciente evolucionó de excelente manera. Se recomendó el manejo adecuado de la paciente puesto que, pese a evolucionar de manera favorable a la enfermedad, continúa siendo un foco de infección. La cantidad eliminada de Leptospiras por la micción es mayor durante las primeras semanas post-infección y puede durar 4 años o más, siendo así posible la transmisión de animal a animal y de animal a humano (McDonough, 2006).
Los seres humanos son susceptibles a la infección por Leptospira y la vía de infección es por la exposición directa o indirecta a la orina de un animal infectado. Por lo tanto, la atención debe enfocarse en la manipulación de fluidos y tejidos animales. Desafortunadamente, a menudo no se establece un diagnóstico de la leptospirosis hasta varios días después de la infección, cuando ya se produce diseminación asintomática. Es recomendable el uso de las precauciones generales para evitar contacto con las membranas mucosas y la orina de los animales. El uso de guantes cada vez que el animal infectado orina, el lavado apropiado de los tejidos en contacto con el mismo y la desinfección adecuada de las áreas habituales del animal, disminuye significativamente el potencial de infección. La Leptospira es en general muy susceptible a los desinfectantes, y las áreas contaminadas pueden ser fácilmente limpiadas. Siempre deben indicarse las repercusiones zoonóticas de la leptospirosis a los propietarios y aconsejar el uso de guantes desechables y desinfectantes de uso doméstico para limpiar los derrames de orina en el hogar (Bolin, 2002).
Discusión
La leptospirosis en perros fue descrita por primera vez en 1899 (Bolin, 2002), es una enfermedad zoonótica de distribución mundial de mayor prevalencia en zonas tropicales que afecta a muchos animales domésticos y salvajes. La leptospirosis es una enfermedad reemergente, la cual se encuentra en la lista B de la OIE (Organización Mundial de Sanidad Animal), por eso es muy importante que anualmente cada país informe sobre el estado de la enfermedad (Romero et al., 2010).
La Leptospira ingresa a un hospedero susceptible y se multiplica tan pronto penetra el espacio vascular (Ettinger & Feldman, 2011), invade el torrente sanguíneo produciendo una bacteremia; con una rápida división y posterior invasión de distintos órganos. La Leptospira posee tropismo por las células de los parénquimas hepáticos, renales y pulmonares así como por las células endoteliales de los capilares (Linzitto & Orellana, 2008) y su presencia en dichos tejidos puede evidenciarse por medio de técnicas especiales, encontrándose entre las lesiones microscópicas cambios a nivel hepático como disociación de las células de las trabéculas parenquimatosas, entre otros.
Los síntomas asociados con la leptospirosis canina, documentados en nuestro caso, tienen similitud con los encontrados por Cano en el 2012, que reporta signos de decaimiento, vómito y fiebre. Uno de los signos más llamativos es la ictericia, la presencia de esta en la leptospirosis canina no es un signo patognomónico, en los casos clínicos se menciona una frecuencia de 10% (Birnbaum et al., 1998). En la literatura consultada existe controversia sobre la signología clínica de la leptospirosis. La manifestación clínica de la leptospirosis es muy compleja y variable, y depende tanto la patogenicidad del serovar, la respuesta inmune del huésped y de la cantidad de bacterias presentes. La Leptospira es transmitida por el contacto directo (agua, orina, suelo contaminado, picaduras, placenta) y por ingestión de tejidos infectados (roedores). Las bacterias se multiplican en la sangre del anfitrión en el primer día después de la infección y colonizan el hígado, riñón, pulmones, bazo, sistema nervioso central y los ojos. Los síntomas van de leve a grave según la afección de los órganos afectados.
En el presente caso la progresión fue rápida y leve, manifestando únicamente signos como ictericia, vómito y decaimiento, conforme se instauró el plan terapéutico la paciente presentó mejoría marcada, las pruebas laboratoriales guiaron el acercamiento diagnóstico y enfocaron el caso hacia enfermedad hepática aguda, los signos y hallazgos generaron sospecha de leptospirosis canina, y posterior a la confirmación mediante la prueba de aglutinación microscópica (MAT), que ha sido ampliamente utilizada como prueba de referencia para la detección de anticuerpos para la enfermedad, se instauró su protocolo terapéutico especifico y la evolución fue favorable. Para el diagnóstico de la leptospirosis canina se han desarrollado además otras técnicas como ELISA, la reacción en cadena de la polimerasa (PCR) en la orina del perro identifica el ADN de varias serovariedades a partir de 100 Leptospiras por mililitro de muestra (Sánchez et al., 2010).
La leptospirosis es una enfermedad de urgencia clínica, en la cual es necesario realizar análisis complementarios para poder diferenciarla de otros trastornos que pudieran provocar ictericia (Luna et al., 2008). Por tratarse de una enfermedad zoonótica de alto riesgo, en la práctica profesional es conveniente informar a los propietarios de las mascotas sobre los riesgos del convivir diario con sus animales, las medidas de manejo e higiene; así como, los cuidados médicos veterinarios mínimos.
Conclusiones
La leptospirosis canina es una enfermedad creciente, es importante resaltar que cualquier paciente con signos y hallazgos de hepatitis aguda, debería incluirse en el diagnóstico diferencial de esta patología. La vacunación es el método preventivo más eficiente, debe realizarse la inmunización primeria en mínimo 3 dosis y posterior revacunación de manera anual. La poca especificidad de los signos de la enfermedad obliga al clínico a indagar mediante pruebas de laboratorio y exámenes complementarios la etiología del trastorno. El diagnóstico de la leptospirosis es una herramienta asequible en la medicina actual y debe realizarse siempre que se tenga sospecha de la presencia de esta. El tratamiento está encaminado a atenuar los signos que el caso produce y a eliminar la infección mediante antibióticos específicos. La leptospirosis canina es una enfermedad a tener en cuenta debido al incremento en la clínica actual y al severo compromiso y morbimortalidad que puede desencadenar.
Referencias bibliográficas
Berdasquera, D.; Cruz, A. Leptospirosis humana una enfermedad olvidada. Revista Cubana de medicina general e integral, v. 25, n.1, p.93-97, 2009.
Birnbaum, N.; Barr, S.C.; Center, S.A.; Schermerhorn, T.; Randolph, J.F.; Simpson, K.W. Naturally acquired leptospirosis in 36 dogs: serological and clinicopathological features. Journal of Small Animal Practice, v. 39, p.231-236, 1998.
Bolin, C.A. Leptospirosis posing new threat for canine hepatic, renal disease. DVM in Focus, June, p.31-34, 2002.
Cano, C.A. Caso clínico de Leptospirosis en un canino. Caldas, Antioquia: Corporación Universitaria Lasallista, 2012; 65p. Tesis (Pregrado Medicina Veterinaria).
Chirathaworn, C.; Inwattana, R.; Poovorawan, Y.; Suwancharoen, D. Interpretation of microscopic agglutination test for leptospirosis diagnosis and seroprevalence. Asian Pacific Journal of Tropical Biomedicine, v.4, p.162-164, 2014.
Courtney, C.H.; Zeng, Q.Y. Comparison of heartworm antigen test kits in dogs having low heartworm burdens. Veterinary Parasitology, v. 96 (4), p.317–322, 2001.
Craxi, A.; Almasio, P. Diagnostic approach to liver enzyme elevation. Journal of Hepatology, v. 25, p.47-51, 1996.
Dufour, D.R.; Lott, J.A.; Nolte, F.S.; Gretch, D.R.; Koff, R.S.; Seeff, L.B. Diagnosis and monitoring of hepatic injury. Recommendations for use of laboratory tests in screening, diagnosis, and monitoring. Clinical Chemistry,v. 46, p. 2050-2068, 2000.
Ettinger, J.S.; Feldman, E.C. Tratado de medicina interna veterinaria. 7.ed. España: Elsevier, 2011. 2208p.
García, M.; Zurita, A. Transaminasas: Valoración y significación clínica. Protocolos diagnóstico-terapéuticos de Gastroenterología, Hepatología y Nutrición Pediátrica Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, v.12, p.267-275, 2010.
Goris, M.G.; Hartskeerl, R.A. Leptospirosis serodiagnosis by the microscopic agglutination test. Current Protocols in Microbiology, v.12, p.5-5.17, 2014.
Linzitto, O.; Orellana, J.S. Leptospirosis clínica humana y animal. Revista de enfermedades infecciosas emergentes, v. 3, p. 15-19, 2008.
Luna, A.M.; Moles, C.L.; Gavaldón, R.D.; Nava, V.C.; Salazar, G.F. La leptospirosis canina y su problemática en México. Revista Salud Animal, v.30, p.1-11, 2008.
Macedo, J.; González, J.; Márquez, M.D. Leptospirosis: zoonosis emergente, informe de un caso. Medicina interna México, v.23, p.244-247, 2007.
Musacchio, H.; Dorigo, C.; Volpato, V. Características clínicas y epidemiológicas de leptospirosis: 10 años de experiencia en Santa Fe, Argentina. Revista panameña de infectología, v. 12, p. 43-46, 2010.
Rodríguez, A.; Ferro, B.; Santafé, M. Evidencia de Leptospira en perros callejeros de Cali. Biomédica, revista del instituto nacional de salud, v. 24, p. 291-295, 2005.
Romero, M.; Sánchez, J.; Hayek, L. Prevalencia de anticuerpos contra Leptospira en población urbana humana y canina del departamento del Tolima. Revista de salud pública, v.12, p.268-275, 2010.
Sánchez, A.; Calderón, J.; Rodríguez, V. Leptospirosis: Enfermedad Endémica en Caninos de Áreas Rurales de Montería (Córdoba).Revista Orinoquia, v.14, p.160-167, 2010.
Srivastava, S. Prospects of developing Leptospiral vaccines for animals. Indian Journal of Medical Microbiology, v.24, p.331-335, 2010.
Valverde, M.A.; Brenes, R.; Sequeiro, J. Confirmación por laboratorio de leptospirosis. Acta Médica Costarricense, v. 50, p.51-54, 2008.
Como citar: Uribe-Castillo, D. Leptospirosis en un Bull terrier. Reporte de un caso. Revista Veterinaria y Zootecnia, v. 10, n. 2, p. 104-114, 2016. DOI: 10.17151/vetzo.2016.10.1.8
Este obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|