|
Control hormonal de la reproducción en hembras ovinas (Ovisaries)
ARTÍCULO DE
(Recibido: mayo 10, 2012 aprobado: agosto 16, 2012)
RESUMEN: En las últimas décadas la reproducción en pequeños rumiantes puede ser controlada por diversos protocolos de sincronización. Algunos de estos métodos involucran la administración de hormonas que modifican la cadena de eventos durante el ciclo estral. En los protocolos de sincronización son usados la progesterona o sus análogos, entre los cuales los más usados son los progestágenos, los cuales imitan la función del cuerpo lúteo (CL).Por otra parte, el uso de las prostaglandinas es una alternativa para controlar la reproducción eliminando el CL e induciendo una subsecuente fase folicular acompañada de ovulación. Adicionalmente, la gonadotrofina coriónica equina (eCG),siendo una hormona análoga a la LH (hormona luteinizante), ayuda con la presentación de la ovulación. Por su parte, la hormona liberadora de gonadotropina (GnRH) estimula la producción de las hormonas folículo estimulante (FSH) y de la LH. El uso de hormonas para inducir el estro ha permitido implementar la inseminación artificial (IA) en hembras ovinas yprogramas de ovulación múltiple y transferencia de embriones.
Palabras clave: estro, eCG, ovinos, progestágenos, prostaglandinas, sincronización
Hormonal control in ovine females reproduction (Ovisaries)
ABSTRACT: Reproduction of small ruminants can be controlled by several methods developed in recent decades through diverse synchronization protocols. Some of these methods involve administration of hormones that modify the physiological chain of events involved in the oestrous cycle. In the synchronization protocols progesterone or its analogues are used among which the most used are the progestagens which imitate the corpus luteum (CL) function. On one hand, the use of prostaglandins is an alternative for controlling reproduction by eliminating the CL and inducing a subsequent follicular phase accompanied by ovulation. Additionally, equine chorionic gonadotropin (eCG), being an analogue hormone to the LH (luteinizing hormone) helps ovulation to appear. On the other hand, the hormone releasing gonadotropin (GnRH) stimulates the production of the follicle-stimulating hormones (FSH) and the luteinizing hormone (LH).The use of hormones to induce oestrus has allowed the implementation of artificial insemination in ovine females and of multiple ovulation and embryo transfer programs.
Keywords: eCG, oestus, progestagens, prostaglandins, synchronization
Introducción
El comercio mundial de la carne de ovino, ha tenido un crecimiento sostenido en la última década, con las mejores perspectivas para América Latina y el Caribe. Países latinoamericanos como Brasil, Chile, México y Uruguay han aumentado el número de cabezas de sus rebaños, al igual que sus índices de consumo interno y exportaciones (Mejía & María, 2010).
La especie ovina es poliéstrica estacional, lo que significa que su conducta reproductiva está ligada a las estaciones, específicamente al fotoperiodo, por lo tanto, se presenta un período de anestro durante una gran parte del año, afectando de esta manera la producción. Sin embargo, en Colombia como país tropical no se presenta este fenómeno tan marcado, aunque sí hay un pequeño descenso en las manifestaciones de estro durante los meses de marzo, abril y mayo (Porras et al., 2003).
La inducción del estro y de la ovulación en ovejas consiste en el uso de métodos farmacológicos efectivos y fácilmente aplicables (Quintero, 2007), que permiten manipular la fisiología reproductiva de las hembras ovinas, permitiendo la implementación de programas reproductivos que permiten optimizar la producción y reproducción (Córdova et al., 1999).
Se hace necesario diferenciar el término sincronización, de inducción; ya que el primero hace mención a hembras con cuerpo lúteo (CL) funcional que están ciclando, en donde se pretende homogenizar lotes de hembras; mientras el segundo, hace referencia a las hembras que están en anestro y se quiere reducir (Mejía & María, 2010).
El objetivo de la presente revisión es describir el uso de las diferentes hormonas disponibles para el control de la reproducción en hembras ovinas, muy especialmente de los progestágenos, prostaglandinas, hormona liberadora de gonadotrofina (GnRH) y gonadotrofina coriónica equina (eCG). Aunque esta metodología ha sido definida para el uso en hembras, debe ser prerrequisito que en todos los casos en que se controla farmacéuticamente la reproducción, esta debe ir acompañada de estudios previos de fertilidad de los machos a ser introducidos (Abecia et al., 2012).
Ciclo estral de la oveja
Se han definido dos fases del ciclo estral en hembras ovinas: una fase luteal desde el segundo día hasta el 13, y una fase folicular que comprende desde el día 14 hasta el día primero, entendiéndose como día cero (0) el día de presentación del estro. El ciclo estral tiene una duración de entre 16 a 18 días, siendo más corto en corderas que ovejas adultas, 16,8 y 17,2 días, respectivamente (Uribe-Velásquez et al., 2009a).
Cuando se sincroniza el estro no es necesario detectarlo, la inseminación artificial (IA) o la monta directa se deben realizar en un tiempo prefijado en relación con el tratamiento hormonal implementado. El tiempo varía un poco entre hembras, aunque el estro en la mayoría de hembras se presentará entre las 36 y 48 horas y la ovulación 60 horas después de retirar el dispositivo con progestágeno. El momento de la IA dependerá del sistema a utilizar, bien sea intrauterina o cervical (Durán, 2008).
La sincronización del estro y de la ovulación en hembras ovinas no depende splo del control en la fase luteal del ciclo estral, sino también del desenvolvimiento ovárico durante la fase folicular (Uribe-Velásquez et al., 2008d), dado que el crecimiento folicular es independiente de la fase del ciclo estral (Goodman & Inskeep, 2006).
Fármacos hormonales utilizados en hembras ovinas
Progesterona (P4)
La progesterona (P4) es una hormona esteroidal que se produce en los ovarios, glándulas adrenales, placenta (Gibbons & Cueto, 1995; Gutiérrez & González, 1998) y luego de la ovulación en el cuerpo lúteo (CL). Como funciones reproductivas de la P4 se pueden citar: estimular el instinto materno; la implantación embrionaria y el mantenimiento de la preñez. Antes de la ovulación, junto a los estrógenos participa en la manifestación externa del estro (Gibbons & Cueto, 1995).
La influencia de la P4es importante para el sistema reproductivo donde ejerce una retroalimentación negativa en el eje hipotalámico-hipofisiario-ovárico disminuyendo la frecuencia y aumentando la amplitud de los pulsos de hormona luteinizante (LH), suprimiendo el crecimiento folicular y bloqueando la ovulación (Gibbons & Cueto, 1995; Boscos et al., 2002; Uribe-Velásquez et al., 2008c), por actuar directamente en el ovario e inhibir el folículo dominante (Uribe-Velásquez et al., 2008c).
Los métodos de sincronización del estro y de la ovulación que utilizan P4 o sus análogos (progestágenos), se basan en sus efectos sobre la fase luteal del ciclo, simulando la acción de la progesterona natural producida en el CL después de la ovulación (Mejía & María, 2010), la cual es responsable de inhibir la GnRH (Hormona Liberadora de Gonadotropina) (Uribe-Velásquez et al., 2009b; Abecia et al., 2012) y consecuentemente también la LH (Hormona Luteinizante) y la FSH (Hormona Folículo Estimulante) (Aké et al., 2003; Olivera et al., 2011). Por lo tanto, controla la vida del CL y las concentraciones circulantes de P4 permitiendo la regulación del ciclo estral y de la ovulación (Abecia et al., 2012). La sincronización con P4 provoca que en el primer estro después del tratamiento se presente una menor tasa de fertilidad (Camacho et al., 2008; Uribe-Velásquez et al., 2009b), al promover la persistencia del folículo dominante con la consecuente ovulación de ovocitos envejecidos y menos fértiles (Abecia et al., 2002; Aisen, 2004).
El uso de los progestágenos es el método artificial más sencillo para inducir la conducta estral y la ovulación en las ovejas, puesto que imita la presencia de un CL de un ciclo estral natural (Mejía & María, 2010). Aunque debido a alteraciones en los patrones de liberación de LH, la calidad de la ovulación, el bienestar animal y en la salud pública, se está cuestionando su uso y se estudian protocolos más cortos, con menos dosis y dispositivos de liberación más efectivos (Abecia et al., 2011).
Los progestágenos más utilizados comercialmente son: el acetato de fluorogestona (FGA) siendo utilizado entre 20 y 40 mg por esponja, y el acetato de medroxiprogesterona (MPA) con 60 mg por esponja (Mejía & María, 2010; Abecia et al., 2011), los cuales han sido eficaces inhibidores del ciclo estral.
Prostaglandina (PG)
La prostaglandina F2α en forma natural es secretada por el endometrio y su función principal es la de inducir la regresión del CL (Martins et al., 1994; Uribe-Velásquez et al., 2008a), entre 15 y 20 horas después de su aplicación (Mejía & María, 2010). Por ello, la administración de PGF2α, ya sea natural o sintética como el cloprostenol, dinoprost y prostianol, que sean aplicados en la mitad o el final de la fase lútea (día 3 al 14) del ciclo estral, provocarán que la fase lútea se acorte, disminuyendo el riego sanguíneo al CL ocasionando así su lisis (Acritopoulou et al., 1977; Acritopoulou & Haresign, 1980; Durán, 2008; Mejía & María, 2010; Vilariño et al., 2010). Además de predisponer a ovejas cíclicas a mostrar comportamiento sexual (Kermani et al., 2012), activando los centros de comportamiento del estro (Oliveira et al., 2006).La PGF2α es una alternativa parala sincronización del estro y de la ovulación (Bozkurt & Aköz, 2006; Uribe-Velásquez et al., 2008d), provocando que permanezcan folículos dominantes (Houghton et al., 1995), durante la temporada reproductiva (Tondello et al., 2010). Las prostaglandinas además inducen una caída en la secreción de P4 (Aköz et al., 2006).
La ventaja más notable en el tratamiento con PGS es la vía de administración intramuscular, lo que conlleva a una mejora en el manejo, sanidad y bienestar de las hembras ovinas (Abecia et al., 2012).Un inconveniente que presenta el uso de PGS es la necesidad de la existencia de un CL, por lo tanto, hembras que estén en fase lútea temprana o fase folicular, serán refractarias al tratamiento. Conociendo la dificultad para determinar con exactitud la fase del ciclo estral de un grupo de hembras, se hace necesaria la aplicación de dos dosis de PGF2α con intervalos de 9 o 10 días (Abecia et al., 2012) u 11 o 12 días de diferencia (Mejía & María, 2010). En la aplicación de la segunda dosis, la mayoría de hembras estarán en la mitad de la fase lútea, por lo que el tratamiento será exitoso (Abecia et al., 2011). Este protocolo es eficaz para la sincronización del estro, pero la fertilidad es del 70% (Abecia et al., 2012), por lo que se recomienda utilizar el estro siguiente para la monta (Durán, 2008). La tasa de preñez con este protocolo en inseminación artificial a termino fijo (IATF) es baja (Olivera et al., 2011). Sin embargo, un tratamiento con PG con 7 o 9 días de diferencia favorece la sincronización de la ovulación, mejorando la maduración de los folículos y aumentando de esta manera la fertilidad, pudiéndose incluso utilizar en protocolos de reproducción asistida en hembras ovinas (Uribe-Velásquez et al., 2008d) y en asocio con progestágenos (Fierro et al., 2013).
Se debe tener en cuenta que, al usar PGS, esta puede causar lisis del cuerpo lúteo también en la gestación temprana (menor a 50 días), por lo que se hace necesario realizar ecografía para verificar que las hembras no estén gestantes al momento de la misma (Mejía & María, 2010).
Gonadotropina coriónica equina (eCG)
La gonadotropina coriónica equina (eCG) se utiliza en varios de los tratamientos de sincronización e inducción del estro y la ovulación (Mejía & María, 2010). Se administra una inyección de eCG al momento de la retirada de los dispositivos liberadores de progestágenos (Abecia et al., 2011). La eCG estimula la producción FSH en principal medida y en menor proporción de LH, lo que aumenta el crecimiento folicular y el reclutamiento de folículos pequeños, aumentando la tasa ovulatoria (Dias et al., 2001), permitiendo que el inicio del estro y de la ovulación se manifiesten de manera más rápida y uniforme (Uribe-Velásquez et al., 2002). La eCG por sí sola disminuye los efectos adversos de la P4 e incrementa la secreción de E2 (Bozkurt & Aköz, 2006; Martínez et al., 2007), haciendo que el estro aparezca precozmente (Uribe-Velásquez et al., 2008b), pero altas dosis de eCG es menos eficiente aislada a diferencia cuando se usa con progestágenos exógenos (Uribe-Velásquez et al., 2002). La eCG se debe administrar con precaución ya que provoca el aumento de la tasa de ovulación (Abecia et al., 2011), pudiendo ocasionar partos múltiples con crías débiles (Durán, 2008).
Tipos de dispositivos para liberación de progestágenos y progesterona
Esponja vaginal
Las esponjas vaginales son dispositivos fabricados a partir de espuma de alta densidad de poliuretano impregnadas con progestágenos 30, 40 o 45 mg de acetato de fluorogestona (FGA) o con 60 mg de acetato de medroxiprogesterona (MAP) (Aköz et al., 2006; Durán, 2008; Abecia et al., 2011). Estas esponjas se insertan en el fondo de la vagina en contacto con el cérvix (Dias et al., 2001). El uso de la esponja predispone a un incremento de la microbiota bacteriana lo cual puede causar vaginitis (Amiridis & Cseh, 2012), además de adherencias que ocasionan problemas reproductivos en el rebaño (Córdova et al., 2008). Sin embargo, es considerado un buen método para la sincronización del estro por su bajo costo y practicidad (Tondello et al., 2010). Además, el porcentaje de hembras que presentan estro es alrededor del 94,4% (Córdova et al., 2008), aunque para elevar su efectividad debe estar asociado a la administración de eCG (Avendaño et al., 2007).
Tampones
Los tampones vaginales de uso humano son fabricados de un material absorbente, los cuales se impregnan con progestágenos (MAP) (Aköz et al., 2006). Estos tampones se ubican de la misma manera que se ubican las esponjas intravaginales, y al estar impregnadas de progestágeno, cumplen la misma función de las esponjas. Los tampones son tan eficientes en la sincronización del estro y de la ovulación como cualquier otro dispositivo intravaginal (Tondello et al., 2010). Tienen la ventaja de ser desechablese higiénicos, y principalmente de bajo costo, además de disminuir la presentación de contaminación bacteriana al momento de la retirada y la presentación de adherencias (Tondello et al., 2010; Vilariño et al., 2010).
Dispositivos siliconados de uso intravaginal
Los dispositivos siliconados de uso intravaginal como el CIDR y el DICO, están fabricados con un elastómero de silicona inerte (Abecia et al., 2012), cargado con progesterona (300 y 400 mg, respectivamente). El porcentaje de hembras en estro es cercano al 100% (Córdova et al., 2008). Con los dispositivos siliconados, la presentación de vaginitis e infecciones vaginales son casi inexistentes (Tondello et al., 2010). El CIDR fue diseñado en Nueva Zelanda en la década de los 80. Recientemente, la Administración de Drogas y Alimentos de los EE.UU. y de la Dirección de Medicamentos Veterinarios de Canadá han aprobado el CIDR (matriz sólida de progesterona) para inducir el estro en ovejas durante el anestro estacional (Abecia et al., 2011).
Crestar
El Crestares un dispositivo de silicona cargado de progestágeno (3mg de norgestomet) que se implanta de manera subcutánea en la cara dorsal de la oreja, permaneciendo allí por 9 días (Cabañas et al., 2006). Este dispositivo no se recomienda, porque el estrés que se ocasiona al momento de la retirada ocasiona grandes pérdidas embrionarias (Córdova et al., 2008).
Protocolos de sincronización en hembras ovinas
Debido a que el CL es la estructura que regula la duración del ciclo estral, se han ideado métodos para manipular el ciclo y sincronizar los estros, basados en imitar la función lútea y métodos que se basan en ocasionar lisis al CL (Abecia et al., 2012).Entre los métodos que imitan la función del CL y actúan inhibiendo la liberación de gonadotropina, se encuentra la administración de progesterona natural o sintética (progestágenos) a través de dispositivos intravaginales (Amiridis & Cseh, 2012) o el Crestar, que es un implante subcutáneo que se ubica en la cara dorsal de la oreja (Tondello et al., 2010).Los progestágenos más usados son la FGA (acetato de fluorogestona) y la MAP (acetato de medroxiprogesterona), los cuales deben aplicarse por periodos similares a la duración del diestro (Mejía & María, 2010).
Progesterona + Prostaglandinas (P4 + PGS)
Se inserta el dispositivo liberador de progestágeno (tampón, esponja o dispositivo subcutáneo) (González et al., 1997), ya sea sintético o natural con 30 a 60 mg, puede ser de MAP o de FGA (Tondello et al., 2010).Se ha demostrado que la respuesta de estro es menor con esponja que con CIDR (Safdariam et al., 2006). El día de la inserción del dispositivo es considerado el día 0 (Vilariño et al., 2010). Si se trata de esponja, tampón o dispositivo siliconado su ubicación es intravaginal de 15 a 20 cm (Córdova et al, 2008). Es necesario tener en cuenta el uso de medidas sanitarias para prevenir infecciones en las hembras, tales como uso de antibióticos y asepsia del instrumental y equipo a utilizar (Tondello et al., 2010).
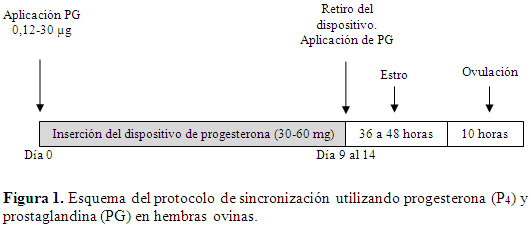
En caso del uso de un dispositivo subcutáneo, debe permanecer por 9 días,y entre 9 a 14 días si se trata de dispositivos intravaginales (Peralta et al., 2007). Al momento de la inserción del dispositivo o de su retirada, se aplica una dosis intramuscular (I.M.) de PGS que oscila de 0,12 a 0,30 µg según el producto utilizado (Uribe-Velásquez et al., 2009b). Al retirar el dispositivo, se suprime la administración de P4 y se anula la inhibición de GnRH. Después de aplicada la PG, se espera que el estro se presente de 36 a 48 h y la ovulación 10 hmás tarde (Figura 1). Con este protocolo, se presenta un incremento en el tamaño de camada, dada la presentación de partos gemelares (Timurkan & Yildiz, 2005), pero una baja tasa de fertilidad y parición por la tendencia a presentar estros infértiles (sin ovulación) (Fernández, 2008).
Prostaglandinas (PG)
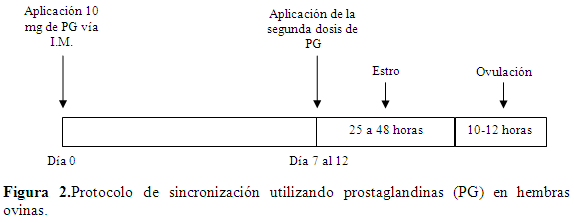
Este protocolo consiste en aplicar vía Intramuscular (I.M.) 10 mg de PGS en dos dosis con un intervalo de 7 a 12 días entre dosis (Uribe-Velásquez et al., 2007). La presentación del estro es de 25 a 48 h luego de la última aplicación, y la ovulación se presenta de 10 a 12 h luego de iniciados los signos de estro (Figura 2). Este estro se presenta con una baja tasa de fertilidad (Cabañas et al., 2006).
Progesterona + Gonadotropina coriónica equina (P4 + eCG)
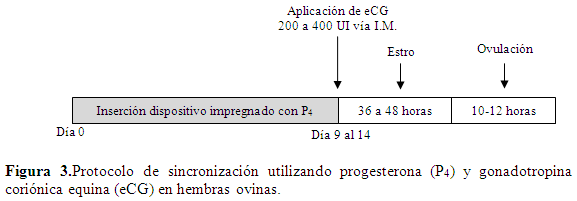
La P4 se maneja igual que en el protocolo con PGS. Cuando se usa implante subcutáneo al momento de su aplicación se aplica valerato de estradiol. En hembras ovinas, el uso del valerato de estradiol está en discusión pues algunos autores citan una mayor vida media afectando así la fertilidad (Suárez, 2010).Luego de retirado el dispositivo, se aplica la eCG ya sea dos días antes de la retirada del dispositivo o al momento de la retirada. La dosis que se aplica es de 250 a 400 UI vía I.M. Como dosis única, aunque se consideran que la dosis efectiva en ovinos es de 550 a 600 UI (Kermani et al., 2012). El porcentaje de hembras que presentan estro es de 96,7% (Avendaño et al., 2007) a100% (Uribe-Velásquez et al., 2008b). El estro se manifiesta de 36 a 48 h después de retirado el dispositivo y aplicada la eCG, y la ovulación de 10 a 12 h después del estro (Naim et al., 2009) (Figura 3). La ovulación inducida por eCG puede causar menor desarrollo embrionario e incrementar la mortalidad fetal (Simonetti et al., 2002; Vilariño et al., 2010), aunque presenta una alta tasa de fertilidad y un mayor porcentaje en la presentación de gestaciones múltiples (Dias et al., 2001; Vilariño et al., 2010). La inducción de la ovulación realizada en repetidas ocasiones con eCG incrementa los estros tardíos por anticuerpos anti-eCG (Dias et al., 2001). Este protocolo hace que la sincronización sea efectiva reduciendo el intervalo estro-ovulación (Uribe-Velásquez et al., 2008b) (Figura3).
Progesterona + Prostaglandina + Gonadotropinacoriónica equina (P4 + PG + eCG)
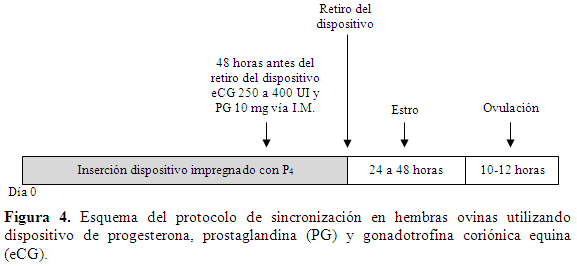
En este protocolo de sincronización el dispositivo con el progestágeno se utiliza de igual manera que en los dos protocolos anteriores. Cuarenta y ocho (48) hantes de retirar el dispositivo, se administran dosis únicas de eCG y PG (250 a 400 UI y 10 mg, respectivamente) ambas por vía I.M. El estro se presentará 24 a 48h (Suárez, 2010) y la ovulación 10 a 12 h después de iniciados los signos de estro, el cual es considerado fértil (Suárez, 2010) (Figura 4).
Hormona liberadora de gonadotropinas + Prostaglandina + Gonadotropina coriónica equina (GnRH + PG + eCG)
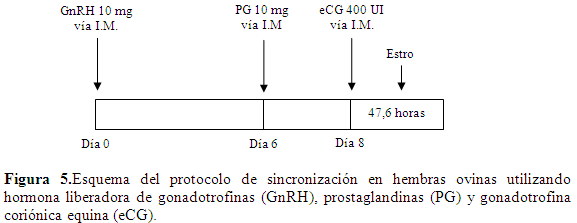
Este en un método eficaz para la sincronización del estro en ovejas. Consiste en la administración de GnRH o sus análogosa dosis de 10 mg vía I.M. (Bozkurt & Aköz, 2006); seis días después se aplica PG a dosis 10 mg vía I.M. Como dosis única, a las 48 h de la aplicación de la PGS se aplica eCG a dosis de 400 UI vía I.M. (Cabañas et al., 2006).La presentación del estro se espera a las 47,6 h luego de aplicada la eCG (Vilariño et al., 2010) (Figura 5).
Hormona liberadora de gonadotropinas + Prostaglandinas + Hormona liberadora de gonadotropinas (GnRH + PG + GnRH)
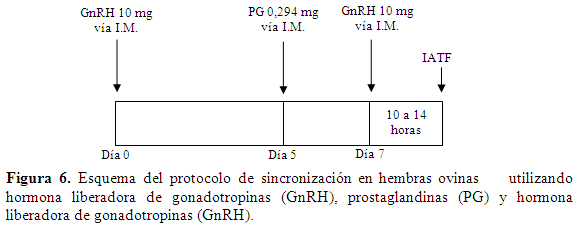
Este método evita el uso de dispositivos intravaginales y permite una predicción precisa del ciclo estral, permitiendo realizar inseminación a término fijo (IATF).Se aplica vía I.M. 10 mg de GnRH; a los cinco días se aplica vía I.M. 0,294mg de PGS como dosis única, y dos días después se aplica GnRH 10 mg vía I.M. La IATF se realiza entre 10 y 14 h después de la ultima dosis de GnRH (Amiridis & Cseh, 2012) (Figura 6).
Conclusiones
El conocimiento de la fisiología reproductiva de las hembras ovinas, las hormonas de interés reproductivo, los dispositivos y protocolos utilizados para la sincronización del estro y de la ovulación, son de gran importancia para el mejoramiento genético de la ovinocultura colombiana. Se hace necesario que a partir del conocimiento teórico, se inicien investigaciones que determinen cuál o cuáles son los protocolos más efectivos en los sistemas productivos, condiciones medioambientales, sanitarias, y recursos genéticos de Colombia.No obstante, la utilización de recursos como la bioestimulación (por ejemplo, los efectos estimulantes en las características reproductivas de las hembras; tales como el inicio de la pubertad; expresión del estro y ovulación, que son inducidas por la presencia del macho),lo cual reemplaza las hormonas exógenas y medicamentos para mejorar la productividad en ovinos y caprinos, debe ser considerada a futuro (Martin et al., 2004).
Referencias Bibliográficas
· Abecia, J.A.; Forcada, F.; González-Bulnes, A.; et al.The effect of progestagen treatment on sheep reproductiveperformance at different phases of the oestrus cycle.Animal Research, v.51, n.2, p.149-155, 2002. · Abecia, J.A.; Forcada, F.; González-Bulnes, A. Pharmaceutical Control of Reproduction in Sheep and Goats.Veterinary Clinics of North America: Food Animal Practice, v.27, n.1, p.67-79, 2011. · Abecia, J.A.; Forcada, F.; González-Bulnes, A. Hormonal control of reproduction in small ruminants.Animal Reproduction Science, v.130, p.173-179, 2012. · Acritopoulou, S.; Haresign, W.; Foster, J.P.;et al. Plasma progesterone and LH concentrations in ewes after injection of an analogue of prostaglandin F-2α.Journal Reproduction and Fertility, v.49, p.337-340, 1977. · Acritopoulou, S.;Haresign, W. Response of ewes to a single injection of an analogue of PGF-2α given at different stages of the oestrous cycle. Journal Reproduction and Fertility, v.58, p.219-223, 1980. · Aisen, E.; editor. Reproducción ovina y caprina. In: Preparación de las hembras. Detección y control del estro y la ovulación. 1. ed. Buenos Aires: Editorial Ínter-Médica, 2004. 206p. · Aké, J.R.; Heredia, M.; Alfaro, M.; et al. Effect of hormone in the superovulatory response and synchrony of estrus on pregnancy rate in pelibuey ewes.Veterinaria México, v.34, n.3, p. 225-233, 2003. · Aköz, M.; Bülbel, B.; Bozkurt, M.; et al. Induction of multiple births in akkaraman cross-bred sheep synchronized with short duration and different doses of progesterone treatment combined with PMSG outside the breeding season.Bull Veterinary Institute Pulawy, v.50, p.97-100, 2006. · Amiridis, G.S.; Cseh, S. Assisted reproductive technologies in the reproductive management of small ruminants.Animal Reproduction Science, v.130, p.152-161, 2012. · Avendaño, L.; Álvarez, F.D.; Molina, L.; et al. Reproduction performance of pelibuey ewes in response to estrus synchronization and artificial insemination in Northwestern Mexico.Journal of Animal and Veterinary Advances, v.6, n.6, p.807-812, 2007. · Boscos, C.M.; Samartzi, F.C.; Dellis, S.;et al.Use of progestagen-gonadotrophin treatments in estrus synchronization of sheep.Theriogenology, v.58, p.1261-1272, 2002. · Bozkurt, M.; Aköz, M. GNRH-PGF2α and PGF2α-PGF2α synchronization in akkaraman cross-bred sheep in the breeding season. Bull Veterinary Institute Pulawy, v.50, p.101-104, 2006. · Cabañas, H.A.; Reyes, R.C.; Martínez, A.; et al. Estrous presentation in ewes pelibuey with PGF2α alone or combined with fluorogeston acetate and equine corionicgonadotrophin. In: XXXI Jornadas Científicas y X Internacionales SEOC, 2006, Castilla y León. Memorias...Instituto Tecnológico Agrario de Castilla y León; 2006.p.369-371. · Camacho, J.C.; Rodríguez, C.; Hernández, J.E.; et al. Características reproductivas de ovejas pelibuey sincronizadas e inducidas a la pubertad. AsociaciónLatinoamericana de Producción Animal, v.16, n.1, p.18-24, 2008. · Córdova, A.; Córdova, M.S.; Córdova, C.A.; et al. Procedimientos para aumentar el potencial reproductivo en ovejas y cabras. Revista Veterinaria, v.19, n.1, p.67-79, 2008. · Córdova, A.; Lang, G.; Oaxaca, J.; et al. Induction and synchronization of heat in creole ewes seasonal anestrus with impregnated vaginal sponge impregnated in FGA and injectable PMSG. Archivos de Zootecnia, v.48, p.437-440, 1999. · Dias, F.E.F.; Lopes, E.S.; Villarroel, A.B.S.;et al. Sincronização do estro, indução da ovulação e fertilidade de ovelhas deslanadas após tratamento hormonal com gonadotrofina coriônica eqüina. Brazilian Journal of Veterinary and Animal Science, v.53, n.5, p.618-623, 2001. · Durán, F. Manual de explotación y reproducción en ovejas y borregos.1.ed. Bogotá: Grupo Latino Editores, 2008.742p. · Fernández, D. Manual de inseminación artificial por vía cervical en ovinos. 1.ed. Secretariado Uruguayo de La Lana, 2008.p.61-68. · Fierro, S.; Gil, J.; Viñoles, C.; et al. The use of prostaglandins in controlling estrous cycle of the ewe: A review. Theriogenology, v.79, p.399-408, 2013. · Gibbons, A.E., Cueto, M.I. Transferencia de embriones en ovinos y caprinos. 1.ed. INTA EEA Bariloche, 1995.p.5-21. · González, C.A.; Catalano, R.C.; Auza, N.J. Oestrus synchronization and induction of reproductive activity in lactating dairy ewes.Avances en Producción Animal, v.22, n.1-2, p.99-103, 1997. · Goodman, R.L.; Inskeep, E.K. Neuroendocrine control of the ovarian cycle of the sheep.In:Neill Jimmy D editors. Knobil and Neill’s Physiology of Reproduction.3.ed. New York: RavenPress, 2006. cap.44, p.2389-2447. · Gutiérrez, J.F.; González, C. Fisiología aplicada a la veterinaria y zootecnia.1.ed. Manizales: Centro Editorial Universidad de Caldas, 1998. 343p. · Houghton, J.A.; LIberati, N.; Schrick, F.N.; et al. Day of estrous cycle affects follicular dynamics after induced luteolysis in ewes. Journal of Animal Science, v.73, n.7, p.2094-2101, 1995. · Kermani, H.; Kohram, H.; Zareh, A.; et al. Ovarian response and pregnancy rate following different doses of eCG treatment in Chall ewes. Small Ruminant Research, v.102, n.1, p.63-67, 2012. · Martin, G.B.; Milton, J.T.; Davidson, R.H.;et al. Natural methods for increasing reproductive efficiency in small ruminants.Animal Reproduction Science, v. 82-83, p. 231-245, 2004. · Martins, L.; Hoff, C.J.; Moura, A.; et al. Dose reduction of prostaglandin for the estrous synchronization in the ewe.Ciencia Rural, v.24, n.2, p.355-358, 1994. · Martínez, J.J.; Izaguirre, F.; Sánchez, L.; et al. Reproductive performance in Black belly ewes synchronized with MPA and eCG during the low fertility season. Revista Científica, v.XVII, n.1, 47-52, 2007. · Mejía, O.; María, P. Características reproductivas de los ovinos. In: Curso teórico-práctico técnicas de reproducción asistida en ovinos, 2010, Guamo (Tolima). Memorias... Asociación de Ovinocultura; 2010. p.66-72. · Naim, P.; Cueto, M.; Gibbons, A. Timed artificial insemination with ram chilled semen.Archivos de Zootecnia, v.58, p.435-440, 2009. · Olivera, J.; Fierro, S.; López, V.;et al.Comparison of prostaglandin- and progesterone-based protocols for timed artificial insemination in sheep. Theriogenology, v.75, n.7, p.1232-1238, 2011. · Oliveira, M.A.; Dias, B.; Toledo, D.;et al.Phisiology and reproductive management in sheep: Revision. Revista Eletrônica Faculdade de Montes Belos, v.1, n.1, p.79-98, 2006. · Peralta, J.G.; Sánchez, M.T.; García, E.O.;et al.Oestrus synchronization of ewes, using norgestomet combined with PGF2α and hCG in the reproductive season. Research Journal of Animal Sciences, v.1, n.1, p.44-48, 2007. · Porras, A.; Zarco, L.A.; Valencia, J. Estacionalidad reproductiva en ovejas. Ciencia Veterinaria, v.9, p.2-14, 2003. · Quintero, J.F. Evaluación de dos protocolos de sincronización del estro en ovejas de pelo criollas. Bucaramanga, Colombia: Universidad Cooperativa de Colombia, 2007. 62p. Trabajo de pregrado (Medicina Veterinaria y Zootecnia). · Safdariam, M.; Kafi, M.; Hashemi, M. Reproductive performance of Karakul ewes following different oestrous synchronization treatments outside the natural breeding season.South African Journal of Animal Science, v.36, p.229-234, 2006. · Simonetti, L.; Ramos, G.; Gardón, JC. Factors affecting reproductive performance of artificial inseminated Merino sheep. Brazil Journal Veterinarian Research Animal Science, v.39, n.3, p.143-146, 2002. · Suárez, I.M. Comparación de la efectividad de tres protocolos de sincronización de celo en ovejas de raza merina. Córdoba, Argentina: Universidad de Córdoba, Departamento de Genética, 2010. 24p. Tesis (Maestría en Producción). · Timurkan, H.; Yildiz, H. Synchronization of oestrus in hamdani ewes: the use of different PMSG doses.Bull Veterinary Institute Pulawy, v.49, p.311-314, 2005. · Tondello, L.; Dos Santos, P.C.; Gaudêncio, S.; et al. Microbiological and functional evaluation of an alternative device (OB®) for estrous synchronization in ewes.Ciencia Rural, v.49, p.389-395, 2010. · Uribe-Velásquez, L.F.; Oba, E.; Lara-Herrera, L.C.;et al.Respostas endócrinas e ovarianas associadas com o folículo da primeira onda folicular em ovelhas sincronizadas com CIDR ou PGF2α. Revista Brasileira de Zootecnia,v.31, n.2, p.944-953, 2002. · Uribe-Velásquez, L.F.; Oba, E.; Lênz, M.I. Respuesta endocrina y ovárica a la sincronización del estro y de la ovulación utilizando CIDR y eCG en ovejas. Veterinaria y Zootecnia, v.1, n.1, p.9-17, 2007. · Uribe-Velásquez, L.F.; Oba, E.; Souza, M.I.L. Población folicular y concentraciones plasmáticas de progesterona (P4) en ovejas sometidas a diferentes protocolos de sincronización. Arquivos de Medicina Veterinária e Zootecnia, v.40, p.83-88, 2008a. · Uribe-Velásquez, L.F.; Lênz, M.I.; Loaiza, A.M. Efecto de la sincronización del estro con prostaglandina F2α vs CIDR + 500 UI de eCG en ovejas bergamacia durante el inicio de la fase luteal.Revista Científica, v.XVIII, n.4, p.368-373, 2008b. · Uribe-Velásquez, L.F.; Oba, E.; Souza, M.I.L. Efeitos da progesterona exógena sobre o desenvolvimento folicular em ovelhas. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v.60, n.1, p.58-65, 2008c. · Uribe-Velásquez, L.F.; Souza, M.I.L.; Osorio, J.H. Origem e características do folículo préovulatório depois de luteólise induzida em diferentes estágios da fase luteal do ciclo estral em ovelhas. Veterináriay Zootecnia, v.2, n.1, p.32-41, 2008d. · Uribe-Velásquez, L.F.; Correa-Orozco, A.; Osorio, J.H. Características del crecimiento folicular ovárico durante el ciclo estral en ovejas. Biosalud, v.8, p.117-131, 2009a. · Uribe-Velásquez, L.F.; Restrepo, R.; Osorio, J.H. Respostas foliculares e endócrinas em ovelhas após sincronização do estro usando progesterona, prostaglandinas (PGF2α) e gonadotrofinas. Veterinária y Zootecnia, v.3, n.2, p.14-27, 2009b. · Vilariño, M.; Rubianes, E.; Van Lier, E.; et al. Serum progesterone concentrations, follicular development and time of ovulation using a new progesterone releasing device (DICO®) in sheep.Small Ruminant Research, v.91, p.219-224, 2010.
Como citar: Lozano-González, J. F. Uribe-Velásquez, L. F. Osorio, J. H. Control hormonal de la reproducción en hembras ovinas (Ovisaries). Revista Veterinaria y Zootecnía 6(2) p.134-147. <http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=155> |