|
Evaluación clínica y tratamiento de la septicemia neonatal bovina
ARTÍCULO DE
(Recibido: marzo 20, 2012 aprobado: julio 26, 2012)
RESUMEN: La septicemia neonatal es una causa importante de morbilidad y mortalidad en neonatología bovina, caracterizada por la presencia de microorganismos patógenos y sus componentes en el torrente sanguíneo. La falla en la transferencia pasiva de inmunoglobulinas calostrales (Ig), las pobres condiciones sanitarias del establo de parto y el inadecuado cuidado umbilical, entre otras causas, predisponen al neonato al desarrollo de la enfermedad. La infección uterina, umbilical, del tracto respiratorio y gastrointestinal pueden ser rutas de infección. Los signos clínicos son generalmente inespecíficos tales como: fiebre o hipotermia, taquicardia, taquipnea, escleróticas inyectadas, hipopión, onfaloflebitis, poliartritis, hipoglicemia, reflejo de succión disminuido, ataxia, convulsiones, recumbencia, desequilibrios ácido-base, alteraciones hemostáticas que conduce a reducción en el retorno venoso, depresión miocárdica y resistencia vascular sistémica con hipotensión progresiva sin respuesta a vasopresores que conlleva a síndrome de respuesta inflamatoria sistémica (SRIS), síndrome de disfunción de órganos múltiples (SDOM), choque séptico y muerte. El diagnóstico es a menudo hecho por la historia clínica y el examen físico, pero la prueba de oro es el hemocultivo. Un tratamiento agresivo debe ser instaurado con terapia antimicrobiana de amplio espectro (basado en el hemocultivo y en los patrones de sensibilidad preferiblemente), terapia antiendotóxica, soporte respiratorio, cardiovascular y térmico que debería ser dirigido con suministro nutricional adecuado. Las estrategias preventivas consisten en asegurar la adecuada transferencia pasiva de Ig a través del consumo de calostro y cuidado umbilical, mantenimiento de un ambiente limpio y asegurar la apropiada reducción la exposición del ternero a patógenos.
Palabras clave: endotoxemia, inflamación, lipopolisacárido, puntuación de sepsis, terneros
Bovine neonatal septicemia clinical assessment and treatment
ABSTRACT: Neonatal septicemia is an important cause of bovine neonatology morbidity and mortality, which is characterized for the presence of pathogenic microorganisms and their compounds in the bloodstream. Failure on passive transfer of colostral immunoglobulin (Ig), poor sanitary conditions in the calving pen and improper umbilical care among others causes predisposes the neonate to the development of the disease. The umbilical, uterine, gastrointestinal tract and respiratory tract infections may be infection routes. The clinical signs are generally nonspecific such as fever or hypothermia, tachycardia, tachypnea, sclera injection, hypopyon, omphalophlebitis, polyarthritis, hypoglycemia, decreased suckling reflex, ataxia, seizures, recumbency, acid-base imbalances, haemostatic alterations leads to reduction in venous return, myocardial depression and systemic vascular resistance with progressive hypotension unresponsive to vasopressors which leads to the systemic inflammatory response syndrome (SIRS), multiple organ dysfunction syndromes (MODS), septic shock, and death. The diagnosis is often made by clinical history and physical examination but the key evidence is blood culture. An aggressive treatment must be established with antimicrobial therapy broad-spectrum (based selection on blood culture and sensitivity patterns preferably), antiendotoxin therapy, respiratory, cardiovascular and thermal support should be addressed along with adequate nutritional supply. The preventive strategies consist in ensuring adequate passive transfer of Ig through colostrums consumption and umbilical care, maintaining a clean environment, and ensuring appropriate reduction of calf exposure to pathogens.
Key words: endotoxemia, inflammation, lipopolysaccharide, sepsis score, calves
Introducción
La protección inmunológica del ternero depende exclusivamente de las inmunoglobulinas (Ig) calostrales, pues la estructura sindesmocorial de la placenta bovina impide la transferencia directa de Ig maternas al ternero antes del parto. Aunque el ternero posee resistencia innata no específica (bajo pH abomasal, la lactoferrina, leucocitos del calostro, el sistema de lactoperoxidasa), entre otros mecanismos, a veces estos pueden ser insuficientes para impedir el ingreso de patógenos al organismo (Constable, 2009; Drago-Serrano et al., 2012). Frecuentemente los terneros septicémicos proceden de novillas primerizas, vacas con mastitis, distócicas o presentan Falla de la Transferencia Pasiva (FTP) de anticuerpos calostrales (Rea et al., 1996; Svensson et al., 2003). En promedio el 30% de los terneros con diarrea son bacterémicos indicando que el riesgo de bacteremia es mayor en terneros con FTP (un 34% y 46%) que en terneros con adecuada transferencia pasiva y que la bacteremia sea mayor en terneros < de 5 días de edad (Fecteau et al., 1997a; Lofstedt et al., 1999). La septicemia neonatal es una enfermedad polimicrobiana (13% y 28%), con baja tasa de supervivencia (< 12%) siendo la Escherichia coli el microorganismo aislado más común (Aldridge et al., 1993).
Se considera FTP si la concentración de IgG es < 10 mg/ml en animales de 24 a 48 horas de edad (Weaver et al., 2000). Se observó que la Escherichia coli también puede ser pinocitada por el epitelio intestinal durante el período de absorción intestinal de macromoléculas. Sin embargo, la colonización del intestino no es un prerrequisito para la invasión. Las vías digestiva y respiratoria así como la vía umbilical, intrauterina, en el canal del parto o heridas son rutas probables de infección (Vaala et al., 2010). La septicemia en terneros diarreicos puede atribuirse también al daño causado por infecciones gastrointestinales bacterianas, virales o parasitarias que permiten el ingreso a la circulación sistémica de patógenos intestinales oportunistas (Fecteau et al., 1997a; Santos et al., 2002) siendo el sobrecrecimiento bacterial en el intestino una fuente de bacteremia.
Una vez los patógenos eluden el sistema inmune del ternero, ingresan al torrente sanguíneo y allí instalados desencadenan múltiples reacciones inmunológicas que alteran y comprometen profundamente la vida del animal debido a los componentes de su membrana en especial el lipopolisacárido (LPS), dado que los rumiantes son extremadamente sensibles a dosis relativamente bajas de LPS (< 5 µg/kg-1) en especial por los efectos marcados sobre la circulación pulmonar (Olson et al., 1995). Entre los microorganismos aislados en diferentes estudios se encuentran Entéricos Gram-negativos: Escherichia coli serotipos 078:K80, 086:K61, 026:K60, O119 (Besser & Gay, 1985), O78, O119:CS31a (Mohamed et al., 1988; Fecteau et al., 2001), O8, O15, O20, O45, 078, O101 y 0103 (Ghanbarphour & Oswald, 2009); O11, O25, O20, O64, 0101 factores de virulencia: aerobactina, Col V, F165, CS31A (Fairbrother, 1993); Klebsiella pneumonia, Klebsiella spp., Klebsiella oxytoca, Salmonella dublin, Salmonella typhimurium, Salmonella spp., Campylobacter spp., Campylobacter fetus subsp fetus y Enterobacter cloacae, Hafnia spp., Citrobacter spp. (Hariharan et al., 1992); así como Cocos Gram-positivos: Staphylococcus spp., Staphylococcus aureus (Kireçci et al., 2010), Staphylococcus hyicus, Staphylococcus simulans, Streptococci, Streptococcus No-hemolitico spp. (Aerococcus viridians, Enterococcus spp.).
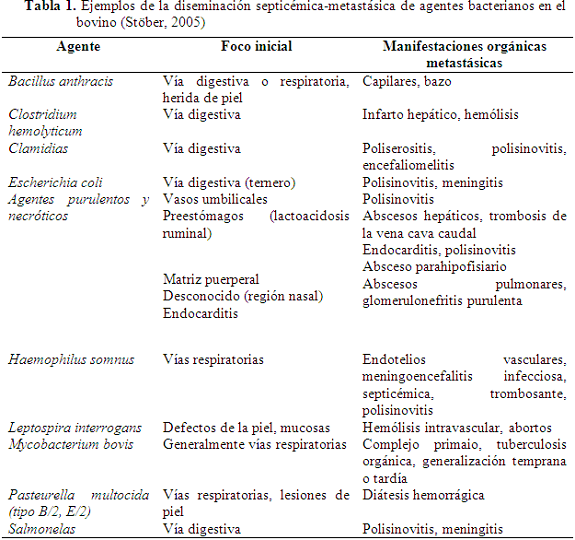
También se han aislado Gram-negativos no entéricos: Pseudomonas aeruginosa, Mannheimia haemolytica, Acinetobacter spp. y otros Gram-positivos tales como Arcanobacterium pyogenes, Bacillus spp., Listeria spp. (Seimiya et al., 1992), Erysypelothrix rhusiopathiae (Kiluge & Perl, 1992); Anaerobios tales como Bacteroides eggerthii, Bacteroides thetaiomicron, Prevotella bivia, Clostridium spp.; y otros organismos asociados a la septicemia neonatal como Actinobacillus suis (Debey et al., 1996), Chromobacterium violaceum (Ajithdoss et al., 2009) y Haemophilus somnus (Little, 1986; Van Donkersgoed et al., 1990). Los agentes etiológicos puede encontrarse en diferentes partes del cuerpo y de allí hacer metástasis a otros sistemas (Tabla 1).
Signos clínicos y hallazgos de laboratorio
Es importante realizar un diagnóstico precoz y así comenzar el tratamiento para impedir que la bacteremia/endotoxemia/septicemia llegue a estado irreversible. Esto es difícil pues la mayoría de signos clínicos son inespecíficos y varían de acuerdo al transcurso y a la magnitud de la enfermedad. Los terneros demuestran letargia, anorexia, pérdida de reflejo de succión, hipoxemia, broncoconstricción, escleróticas inyectadas, hipopión, onfaloflebitis, poliartritis, ataxia, convulsiones, recumbencia, oliguria, anuria, ictericia, azotemia pre-renal (orina gravedad específica < 1.025), desequilibrios ácido-base, entre otras manifestaciones clínicas (Roussel et al., 1997; Smith, 2005). La dilatación persistente de las arterias o venas umbilicales con un fluido hipoecoico a ecogénico es sospechosa de infección (Fecteau et al., 2005). Además, se observa una disminución de la contractibilidad cardíaca con elevación de la troponina cardiaca I (cTnI) e hipotensión sistémica la cual incrementa el tono simpático (Constable et al., 1991b; Constable, 1999; Peek et al., 2008).
Otros hallazgos incluyen hiperglicemia transitoria (inicialmente) seguida de un período prolongado de hipoglicemia por la aceleración de la glucogenólisis y la liberación de catecolaminas con la subsecuente liberación de insulina que conduce a utilización incrementada de glucosa y depleción progresiva de las reservas de glucagón (Constable et al., 1991a) con disminución del zinc plasmático (Kenison et al., 1991; Ballou et al., 2011).
En animales adultos la endotoxina causa estasis ruminal y aumenta el tiempo entre el estro y la ovulación (Eades, 1993; Lavon et al., 2008). En los estadios iniciales de la sepsis la estimulación del sistema nervioso simpático resulta en taquicardia, gasto cardíaco incrementado y consumo de oxígeno (O2) incrementado. Como la sepsis progresa, se reduce la entrega de O2 hacia los tejidos periféricos desarrollando metabolismo anaeróbico conduciendo a acidosis metabólica (acidosis por iones fuertes por disminución en la Diferencia de Iones Fuertes [↓DIF+]) con elevado anion gap por generación y acumulación de ácidos orgánicos endógenos (ácido láctico por hipoperfusión, baja entrega de O2 y metabolismo anerobio que lleva a producción y acumulación de l-lactato) y presencia de aniones urémicos –azotemia pre-renal– (Constable et al., 1991a). El perfil bioquímico sérico es útil para la detección de las alteraciones ácido-base en los rumiantes (Staempfli, 2005).
En los estadios finales de la sepsis se desarrolla hipotermia, catabolismo y gasto cardíaco disminuido con hipotensión severa (Vaala & House, 2002). La hipovolemia, la hipotensión sistémica arterial y la liberación de vasopresina resultan en una reducción significativa en la tasa de filtración glomerular y producción de orina (Constable et al., 1991b). Así mismo, la hipertensión pulmonar incrementa la presión hidrostática microvascular, incrementa la filtración del fluido intravascular y el edema pulmonar puede desarrollarse si la hipertensión se acompaña de la permeabilidad microvascular aumentada (Constable et al., 1991b).
A su vez, el riñón disminuye su capacidad de concentrar orina (indicado por la disminución gradual en la reabsorción de agua libre) así como una reducción progresiva en la excreción de sodio y fósforo atribuida a la disminución en la carga de sodio filtrado, evidenciado en la tasa disminuida de filtración glomerular y un incremento en la reabsorción de sodio como consecuencia de la hipovolemia (Constable et al., 1991a). El nivel sérico de fósforo aumenta en la endotoxemia, asociado a la disminución progresiva en la excreción de fósforo urinario. La hiperfosfatemia probablemente resulte de la hidrólisis de los fosfatos orgánicos de alta energía secundario a la hipoxemia o en respuesta a la disminución en la tasa de filtración glomerular (Constable et al., 1991a) mientras que los valores de hierro y magnesio aumentan en el estado febril (Samad et al., 2003) así como los valores del hematocrito, número de eritrocitos, hemoglobina, colesterol, fosfolípidos, el calcio, fósforo inorgánico, las concentraciones de fosfatasa alcalina, T3 (3,5,3´-triyodotirosina) y la actividad de la gamma-glutamiltransferasa (Kinsbergen et al., 1994).
También se observa leucopenia atribuida a la inmediata acumulación, marginación y activación de leucocitos en la microcirculación (capilares alveolares), linfopenia debida a la liberación de corticoesteroides endógenos, neutropenia (vacuolización, gránulos “tóxicos”, y cuerpos de Dohle) posiblemente a causa del secuestro pulmonar de neutrófilos, trombocitopenia presuntamente por el secuestro de plaquetas en el pulmón, hígado y lecho capilar esplácnico (Smith, 2005), cambios en células blancas, fibrinógeno aumentado y puede encontrarse prolongado el tiempo parcial de tromboplastina activada (Aldridge et al., 1993; Irmak et al., 2006). Existe variación individual frente a la respuesta de proteínas de fase aguda (Jacobsen et al., 2002; Andersen et al., 2004) sugiriendo ser más útil para distinguir entre inflamación aguda y crónica el suero amiloide A que el conteo de células blancas (Coskun & Sen, 2008). La haptaglobina alivia los efectos deletéreos del hierro libre (hemoglobina liberada por eritrocitos dañados) y restringe su disponibilidad para las bacterias (Petersen et al., 2004). Además, la endotoxina involucra prostaglandinas y óxido nítrico (NO) lo que aumenta la actividad en el músculo liso intestinal de la óxido nítrico sintetasa cambiando la propagación de las contracciones yeyunales, resultando en un tránsito intestinal rápido y probablemente en diarrea (Smith, 2005).
Fisiopatología
La endotoxina es un componente de la membrana celular de las bacterias gramnegativas constituida por el lipopolisacárido (LPS), integrado por una cadena hidrófila externa o terminal de unidades repetidas de oligosacáridos con características antigénicas únicas para cada cepa y serotipo de microorganismo, un núcleo polisacárido central y un componente lípido no polar proximal incluido en la capa fosfolipídica del envoltorio externo (lípido A) compuesto de un alfa 1,6-D-glucosamina disacárido ligado ulteriormente por oscilación a ácidos grasos (ácido mirístico) (Koot, 1993). Por su parte, las bacterias Gram (+) contienen ácido lipotecoico (ALT) y ácidos teicoicos unidos al peptidogluclano de su pared celular.
Cuando el LPS invade el sistema circulatorio se liga a una variedad de proteínas (albúmina, complemento, lipoproteínas) entre ellas la proteína fijadora de lipopolisacáridos (LBP) (Schroedl et al., 2001) induciendo la translocación del factor nuclear kappa B (NF-КB) y originando interleucina 1 (IL-1) y factor de necrosis tumoral (TNF-α) por parte de los macrófagos y células endoteliales, expresándose así las selectinas que mediante unión débil ligan los leucocitos a la célula endotelial y también se expresan las integrinas (unión firme). Este complejo a su vez se une con la membrana CD14 de los macrófagos intravasculares (intrapulmonares y células de Kupffer) iniciando respuestas intracelulares. Las citocinas (IL-1α, IL-1β) y el TNF-α circulando en la sangre actúan sobre el hipotálamo induciendo la fiebre (Smith, 2005). Los niveles altos de FNT, IL-1 e IL-6 se asocian con la severidad de la enfermedad (Basoglu et al., 2004). Las exotoxinas de las bacterias Gram (+) se adhieren a la membrana celular y crean poros que admiten la translocación bacteriana; a su vez el ALT activa las células T, eleva los niveles de citoquinas y también se unen al complejo mayor de histocompatibilidad (CMH) tipo II. Estímulos como el TNF-α, IL-1, el ALT, la unión de LPS a la membrana CD14 en presencia de (LPB), conducen a translocacion del NF-kB y liberación de TNF-α los peptidoglicanos y el ADN bacteriano provoca la activación del factor nuclear kappa B (NF-кB) por medio de su interacción con receptores transmembranales tipo Toll (TLRs) (Schroedl et al., 2001; Wang et al., 2003).
La interacción entre los patógenos y sus huéspedes es iniciada por la activación de los receptores de reconocimiento de patógenos (PPRs), entre ellos los TLRs que reconocen específicamente a patrones moleculares asociados a patógenos (PAMPs). Los TLRs son glicoproteínas transmembranales expresadas sobre la superficie celular y compartimientos intracelulares de células epiteliales y células inmunes (macrófagos y células dendríticas). Los ligandos de TLRs incluyen moléculas PAMP. El bovino posee TLR1 a TLR10 y gen para Proteína 1 de reconocimiento de peptigdoglucano (PGLYRP1) que se une a una variedad de componentes microbianos y mata diversos microorganismos (White et al., 2003; Seabury et al., 2007; Seabury et al., 2010; Smith et al., 2012). Los TLR3, TLR7, TRL9 y las células γδ T se destacan en infecciones respiratorias en el bovino (Schneberger et al., 2011; McGill et al., 2013) así como las variantes en los genes para TRL1 se asocian con la susceptibilidad a la Tuberculosis Bovina (Sun et al., 2012). Los TLR2 reconocen otros componentes de la pared celular (ALT, peptidoglucano, lipoproteínas) y también en LPS de Leptospira interrogans (Ibeagha-Awemu et al., 2008). Cuando el LPS invade el sistema circulatorio se liga a una variedad de proteínas (albúmina, complemento, lipoproteínas) y a la proteína fijadora de lipopolisacáridos (LBP) la cual lo transfiere al receptor del complejo CD14/MD-2/TLR4. La activación del TLR4 por este complejo induce 2 vías de señalización por proteína adaptadora MyD88 (factor de diferenciación mieloide 88) dependiente e independientes (Ibeagha-Awemu et al., 2008; Fu et al., 2013).
La activación por vía MyD88 dependiente se origina en el dominio TIR (Toll/IL-1 Receptor) asociada a TLRs. El MyD88 se liga a IRAK-4 (cinasa 4 asociada al receptor de IL-1) e IRAK-4 fosforila a IRAK-1. Éste a su vez se ensambla al Factor asociado al receptor de TNF (proteína TRAF-6). IRAK-1 y TRAF-6 se asocian con otro complejo proteico formado por TAK1 (cinasa activada de TGF-β) y TAB1 y 2 (proteínas adaptadoras de unión a TAK1). Ya desarrollado este complejo proteico se generan una vía independiente de señalización que conduce a la activación del sistema NF-кB, y otra que activa las proteínas cinasas activadas por mitógeno (MAPK). En la activación del NF-кB primero TAK 1 fosforila y activa el complejo de kinasas Iкβ (IKK’s) y a su vez fosforila a la proteína inhibidora кB (IкB) para su subsecuente ubiquitinación degradando a la IкB. Así el NF-кB queda libre para translocarse al núcleo. En el núcleo el NF-кB se fosforila directamente y ocurre la acetilación de histonas que envuelven varios genes blanco para NF-кB lo cual establece la intensidad y la duración de la respuesta transcripcional de NF-кB (Oviedo-Boyso et al., 2007) y la posterior expresión de la cicloxigenasa II (COX II) y liberación de prostaglandina E2. El crecimiento excesivo bacteriano y la producción de citosinas se controlan a través de Proteína de interacción Toll (TOLLIP) que sirve como regulador negativo de señalización-TLR. Las endotoxinas a través de las integrinas también activan el NF-кB.
Por la vía MAPK la activación de TAK1 induce la fosforilación de las MAPK lo que causa la translocación nuclear del factor AP1 (Activador de Proteína-1). De otra parte, la vía MyD88 independiente solo es empleada por TLR3 y TLR4. La proteína acopladora TRIF (adaptador que contiene el dominio TIR e induce IFN-β) incorpora al complejo proteico TRAF6-TAK1-TAB2 que activa el complejo de kinasas permitiendo la liberación de NF-кB. Por medio de otra ruta, la molécula TRIF interactúa con el dímeroTBK1/IKK-i y provoca la síntesis de transcripción del factor IRF3 (Factor regulador de IFN-3) y la producción de IFN-β.
Así, las células endoteliales liberan además otros mediadores celulares por vía de la COX II tales como: la prostaciclina (PGI2) potente vasodilatador que inhibe la agregación plaquetaria y la adherencia de los neutrófilos segmentados (junto con el ON, preservan el flujo sanguíneo en lechos vasculares vitales manteniendo el aporte de O2 crítico); la PGE2 que induce vasodilatación, hiperalgesia y edema. Por vía de la lipooxigenasa genera el LTB4 (metabolito no peptídico) promoviendo la leucotaxis y la quimiocinética de los segmentados y macrófagos y estimula las hidrolasas lisosómicas. Además el LPS activa el complemento por la vía alterna (C3a, C5a), induce la liberación del factor activador de plaquetas (PAF) y promueve la desgranulación de los mastocitos pulmonares (Jolly et al., 2001), la generación de NO catalizado por la formación de óxido nítrico-sintetasa (formado por metabolismo de L-arginina en endotelio vascular) y también se generan bradicininas. La magnitud de la respuesta de mediadores se eleva en el siguiente orden: tromboxano B2, factor de necrosis tumoral (TNF), seguidas de TxB2 y PGF1α e interleuquina-1 β (IL-1 β) y reflejan la cantidad de endotoxina circulante (Adams et al., 1990; Gerros et al., 1993; Bieniek, 1998).
El Síndrome de respuesta inflamatoria sistémica (SRIS) ocurre en respuesta a un proceso infeccioso confirmado denominado sepsis que puede culminar en choque séptico. Es caracterizado por hipoperfusión e hipotensión refractarias a la administración de líquidos requiriendo asistencia cardiovascular farmacológica para mantener la presión arterial. Como el LPS activa el factor XII de la coagulación el fibrinógeno se convierte en fibrina (a través de la trombina) conduciendo a Coagulopatía Intravascular Diseminada (CID). Así mismo se produce el factor XIIa de la coagulación convirtiendo la precalicreína plasmática en calicreína dando lugar a la fragmentación de cininógeno de alto peso molecular (HMWK), se produce bradicinina y aumenta así la permeabilidad vascular (pulmonar y sistémica) que lleva a acumulación de líquido intersticial, edema tisular, poliuria inapropiada y aumento de las pérdidas insensibles que restringen aún más la volemia circulante efectiva. Esa baja perfusión conduce a la persistencia del déficit de perfusión, el foco infeccioso, el consumo de O2 dependiente del flujo, la inflamación y el tejido necrótico transforman el SRIS estable en Síndrome de disfunción de órganos múltiples (SDOM) irreversible (Cipolle et al., 1994) caracterizado por la alteración de la función orgánica en paciente con enfermedad aguda cuya homeostasis no puede ser mantenida debido a la persistencia en el déficit de perfusión, al consumo de O2 dependiente del flujo y la inflamación.
Diagnóstico
La historia y los signos clínicos hallados, asociados a los factores predisponentes podrían indicar la presencia o ausencia de septicemia junto con los hallazgos de patología clínica. Sin embargo, existen modelos clínicos de puntaje de sepsis para predecir tempranamente la presencia de bacteremia en terneros (Fecteau et al., 1997b) los cuales consisten en asignar puntajes a algunos hallazgos clínicos y otros parámetros del paciente. De este modo, se totaliza el puntaje de sepsis y así se determina posteriormente la posibilidad (%) de bacteremia con el fin de instaurar tratamiento inmediato. Este modelo tiene una sensibilidad del 75% y una especificidad del 71% (Fecteau et al., 1997b).
El diagnóstico definitivo se realiza mediante la identificación del(los) agente(s) patógeno(s) del hemocultivo, urocultivos y cultivos de todos los sitios y líquidos biológicos sospechosos (líquido sinovial, líquido cefalorraquídeo –LCR–, abdominal o pleural) ya que los microorganismos pueden ubicarse en diferentes órganos y ser excretados a través de las heces, vesícula biliar, orina y diferentes secreciones (Raboisson et al., 2010; Biolatti et al., 2012). Así, los cultivos de otros fluidos podrían ser útiles para diagnóstico bacteriológico cuando el cultivo sanguíneo sea negativo debido al tratamiento antibiótico precoz o a falla en toma de la muestra (Fecteau et al., 2009). Se debe tomar la muestra (sangre u otros fluidos) de forma aséptica y depositarla en medios de cultivo aeróbico (polienatol sulfonato de sodio –SPS-) y anaeróbico (infusión de cerebro y corazón; Brain-heart infusión- BHI-) o a través del sistema de hemocultivo BACTEC 9240® (Kireçci et al., 2010). Un cultivo positivo es caracterizado por la turbidez luego de 12 a 48 horas de incubación. Posteriormente, se realiza la tinción de Gram (+ o -) y prueba de sensibilidad a antibióticos para determinar la terapia antimicrobiana a suministrar.
Tratamiento
Siempre el pronóstico es reservado. Se debe instaurar la reanimación si el paciente se encuentra inconsciente. Se despejan vías aéreas y se suministra oxígeno. La cianosis a una presión arterial de oxígeno (PaO2) < 40 mm Hg es evidente. Si se presenta hipoxemia (PaO2 < 70 mm Hg) con PaCO2 baja o normal, o con hipercapnia (PaCO2 > 50 mm Hg) se suministra O2 intranasal de 8 a 10 L/mg con monitoreo permanente de gases arteriales sanguíneos esperando corregir la hipoxemia en pocas horas. El doxapram intravenoso (2 mg/kg) podría indicarse en terneros con asfixia cuando la intubación y la ventilación mecánica no sean viables (Bleul et al., 2010) así como el clenbuterol IV (0,8 µg/kg) que reduce la resistencia respiratoria oscilatoria y aumenta la PaO2 (Genicot et al., 1995) descontinuando el O2 gradualmente (más de 48 horas). Dejar caer la cabeza por debajo del nivel del corazón puede facilitar el llenado de la yugular para el catéter de reemplazo con una aguja de calibre 16 (3,5 pulgadas) (Nagy, 2009).
Si el pH sanguíneo es < 7,20 el lactato Ringer restablece flujo renal y permite la excreción urinaria de lactato mejorando la perfusión de los órganos. Si el pH es > 7,20 entonces estaría indicada la solución isotónica de bicarbonato (Constable, 2011a). Si el ternero ya está en estado de choque séptico se debe administrar solución salina hipertónica 7,2% a 4 ml/kg, vía intravenosa, durante 4-6 minutos la cual incrementa rápidamente el volumen plasmático, seguida de la administración de una de solución isotónica de bicarbonato de sodio con una DIF+ efectiva de a 167 mEq/L (1,4% NaHCO3/L) de 1 a 4 Litros IV, la cual es alcalinizante porque aumenta la DIF+ en la sangre (Constable, 2008; Müller et al., 2012). Además se deben agregar 80 a 100 ml/kg para el mantenimiento diario y hasta 7 L/día en las primeras 24 horas para reponer las pérdidas actuales; no obstante, si se restablece el reflejo de succión con las primeras infusiones de líquidos intravenosos (IV), los requerimientos diarios podrían suministrarse por vía oral para reducir los costos. Se recomienda administrar por vía intravenosa solo 1/3 del líquido total para reanimar al ternero y restaurar la circulación. Durante la administración rápida del primer litro de solución el veterinario puede controlar y ajustar la velocidad (Baquero-Parrado & Fuentes-Reyes, 2007). La corrección de la azotemia (concentración de creatinina plasmática o sérica > 2,0 mg/dl) se logra 24 a 48 horas después de la rehidratación (Roussel et al., 1997).
Los líquidos se administran entre 30 a 50 ml/kg/hora en terneros para evitar sobrehidratación y edema pulmonar en especial cuando la concentración de proteínas plasmáticas totales es inferior a 4 mg/dl (Berchtold, 2009). La sobrehidratación puede asociarse con anemia e hipoproteinemia, conduciendo a hipoxia cuando el hematocrito cae por debajo del 15%. Valores de hemoglobina menores de 5 g/L (hematocrito 15% aproximadamente) o con taquicardia superior a 110 latidos por minutos pueden ser indicadores de la necesidad de una transfusión sanguínea (Hunt & Wood, 1999). La sangre puede recolectarse (si va a utilizarse inmediatamente) con 10 ml de citrato de sodio (3,85%) por cada 100 ml de sangre recolectada y debe calentarse en un baño de agua a 40°C hasta llegar a los 37°C previniendo arritmias cardíacas y respuestas hipotérmicas por parte del receptor. La administración lenta de sangre completa de 10 a 30 ml/kg (sin exceder los 10 ml/kg/hora) o la transfusión de plasma de 10 a 15 ml/kg (Ravary-Plumioën, 2009) pueden ser útiles en terneros privados de calostro; aunque otros autores sugieren de 20 a 40 ml/kg (Hunt & Wood, 1999). Lo ideal es que la vaca donadora de sangre no tenga antecedentes de vacunación frente a anaplasmosis, enfermedad de Johne o brucelosis. La administración 4 a 5 ml IM o 0,2 a 0,5 ml IV de HCl de epinefrina 1:1000 puede revertir los signos de anafilaxia si llegan a presentarse (Hunt & Wood, 1999).
Como inotrópicos la dopamina estimula directamente los receptores adrenérgica α1 y α2 y los receptores dopaminérgicos presinápticos y postsinápticos, tiene acción β-adrenérgica potente y α-adrenérgica vasoconstrictora periférica. Si la dopamina no eleva la tensión arterial o se comprueba taquicardia excedida se recurre a la norepinefrina (α-adrenérgico periférico más fuerte) a dosis de 2 a 5 µg/kg/hora teniendo en cuenta que las catecolaminas pueden elevar los niveles de lactato por incremento de la glucolisis. La dobutamina (10 µg/kg/minuto) eleva el retorno venoso y podría ayudar al incremento del volumen minuto (Vincent et al., 1990).
Antiinflamatorios como el flunixin meglumine (1,1 mg/kg, IV, cada 24 horas) o el ketoprofeno (2,2 mg/kg, IV) mitigan los signos clínicos asociados con la endotoxemia (Semrad, 1993a; Semrad, 1993b) sin sobrepasar los 3 días de administración para evitar lesiones consistentes con toxicosis por antiinflamatorios no esteroides como las observadas con la fenilbutazona (Semrad et al., 1993; Fecteau et al., 2009). Una dosis única de succinato sódico de metilprednisolona (1,1 mg/kg) podría disminuir la agregación de neutrófilos, la activación y desgranulación leucocitaria previniendo la CID (Semrad, 1993a; Ravary-Plumioën, 2009). La dexametasona disminuye los niveles de factor de necrosis tumoral (Ohtsuka et al., 1997).
Los antibióticos a suministrar deben cubrir el espectro grampositivo y gramnegativo como cefalosporinas (ceftiofur, 5-10 mg/kg una a tres veces al IM o IV día, al menos durante 3 días) o cefquinoma (2 mg/kg, IM, cada 24 horas durante 3 a 5 días). Se recomienda también la ampicilina sódica (10-20 mg/kg, cada 8 horas IV) o sulfonamidas potenciadas (25 mg/kg IV o IM cada 24 h) o el trihidrato de amoxicilina (10 mg/kg cada 12 horas oral) solo o combinado con el inhibidor clavulanato potásico (12,5 mg/kg droga combinada) cada 12 horas (Thomas et al., 2004; Constable, 2011b; Fecteau et al., 2009) teniendo en cuenta que algunos microorganismos presentan resistencia a tales antibióticos (Kireçci et al., 2010). Se puede administrar conjuntamente la enrofloxacina a dosis de 2,5 a 5 mg cada 24 horas. Se ha postulado el sulfato de polimixina B (interactúa con el lípido A formando un complejo estable que altera la estructura y función de la membrana celular bacterial lo cual podría ser usado como agente profiláctico) pero su afinidad por los fosfolípidos aniónicos de las membranas celulares la convierten en nefrotóxica, ototóxica y neurotóxica (Olson et al., 1995).
Como la endotoxina afecta la absorción de glucosa intestinal (Bieniek, 1998) se puede administrar 25 ml de dextrosa al 50% en un bolo IV (Pérez-García, 1999; Ravary-Plumioën, 2009) aunque eventualmente puede inducir hiperinsulinemia lo que podría deteriorar el estado del ternero. Conviene alimentar la ternero con aproximadamente del 10 al 15% del peso vivo en leche de 4 a 5 veces al día. Los requerimientos energéticos para crecimiento han sido estimados en 307 y 268 kcal/100 g de ganancia de peso corporal y los de mantenimiento estimados entre 52,4 y 44,7 kcal/kg de peso por día. Como la leche entera contiene cerca de 70 kcal/100 ml, un ternero neonato necesitaría cerca de 3 litros de leche entera para mantenimiento y 4 a 5 litros adicionales para ganar 1 kg de peso (Vaala & House, 2002).
Complicaciones
Meningitis: Se observan animales opistótonos, con fiebre y letargia. El LCR sirve para proporcionar un diagnóstico antemortem siendo menos arriesgado recolectarlo del espacio lumbosacro [en la depresión de la línea media entre la última espina dorsal lumbar palpable (L6) y la primera espina dorsal sacra palpable (S2)] conservando la muestra en un tubo aséptico con EDTA (Stokol et al., 2009). Escherichia coli es frecuentemente aislada en casos de meningitis por septicemia (Green & Smith, 1992). El análisis del LCR revela pleiocitosis neutrofílica (Stokol et al., 2009), xantocromía, turbidez y alta concentración de proteínas totales (> 1,0 gr/L) predominando los neutrófilos (< 80%) en LCR en terneros con enfermedad aguda. La concentración de potasio y la actividad de AST, LDH, CK incrementan significativamente mientras que las concentraciones de fósforo, sodio y magnesio disminuyen significativamente (Nazifi et al., 1997). El metabolismo de las bacterias (si están presentes en LCR) disminuye los niveles de glucosa en LCR. La administración de ceftiofur (5 a 10 mg/kg una a tres veces al día IV o IM), ampicilina sódica (10-20 mg/kg tres veces al día IV), enrofloxacina (10 mg/kg IV una vez al día) o florfenicol (20 mg/kg IV) y sulfonamida-trimetropim (5 mg/kg basado en el trimetoprim IV, 2 a 3 veces al día). Para disminuir las convulsiones se administra diazepam (0,01-0,2 mg/kg, IV) cada 30 minutos hasta que estén controladas (Fecteau & George, 2009).
Artritis séptica: Generalmente afecta varias articulaciones en especial las del carpo y tarso. Claudicación del(los) miembro(s) afectado(s), articulaciones calientes y aumentadas de tamaño, dolor a la presión y a la flexión pasiva, distensión de la cápsula articular con inflamación de los tejidos adyacentes son algunos de los hallazgos en la artritis séptica. La región de la fisis está predispuesta a desarrollar infecciones pues el flujo de sangre es disminuido, y por la baja tensión de oxígeno que conduce a trombosis y necrosis isquémica de la fisis, así como en trombosis de los vasos vasculares de la membrana sinovial afectando el metabolismo del cartílago permitiendo el ingreso de proteínas séricas, leucocitos y enzimas proteolíticas en el fluido sinovial alterando su producción y drenaje, lo que interrumpe la capacidad de reparación de los condrocitos causando eventual degradación del cartílago articular. Posteriormente se puede desarrollar osteomielitis, fisitis, osteoartritis con pobre pronóstico de recuperación (anquilosis) y con eventual cierre temprano de la fisis. Cuando el ternero tiene más de una articulación infectada el pronóstico es aún peor.
El conteo de células nucleadas (> 25000 células/microL), o de células polimorfonucleares (> 20000 células/microL; o > 80% de polimorfonucleares) y proteínas totales (> 4,5 g/dl) al examen del liquido sinovial es sospechoso de artritis infecciosa (Rohde et al., 2000; Francoz et al., 2005). La radiografía puede revelar proliferación periosteal y la ultrasonografía y la artroscopia son útiles en el diagnóstico (Munroe & Cauvin, 1994). La terapia debe comenzar tan pronto sea posible disminuyendo así el riesgo de lesiones irreversibles. La administración trihidrato de ampicilina 10 mg/kg IM cada 12 horas (Brown et al., 1991), cefquinoma (Cobactan® 2,5%) a dosis de 1 mg/kg diaria durante 10 días (Fraipont et al., 2002) o 2 mg/kg diaria, IM durante 5 días (Guatteo et al., 2010) estarían indicadas. Conviene anotar que la administración de doxiciclina intraarticular puede disminuir la actividad de la enzima metaloproteinasa de la matriz otorgando así un eventual efecto condroprotector (Haerdi-Landerer et al., 2007). También se dispone de la implantación intrasinovial de esponjas de colágeno embebidas en gentamicina (por 1 o 2 semanas más) ampliando la mejoría de éxito terapéutico aunque sus altos costos limitan su uso.
El lavado articular remueve los coágulos de fibrina y demás desechos celulares. El líquido sinovial es colectado para cultivo y examen microscópico. La primera de dos agujas (14’’) es colocada dentro de la articulación. Se infunde a través de la primera aguja y apretando la bolsa del lactato Ringer (sin antibiótico) o solución de plivinilpirrolidona-yodo 0,1% (-0,4%) así como digluconato de clorhexidina 0,05% administrando a presión 250 a 500 ml en dirección opuesta (a la segunda aguja), colocando la segunda aguja (lo más distante posible de la primera aguja) hasta que el líquido salga sin alteraciones. Al finalizar el lavado de la articulación se puede infundir antibiótico en la articulación. Se puede repetir el procedimiento al día siguiente, esperar 48 horas y repetir una vez más.
Prevención
El requerimiento de inmunoglobulinas (Ig) calostrales para el ternero recién nacido es aproximadamente de 80 a 150 g si el ternero es alimentado dentro de las primeras 2 horas de nacido (Godson et al., 2003) pues la expresión de TLR2, TLR4, β-defensina y del PGLYRP1 solo se detectó en ciego y colon en terneros a partir de los 6 meses de edad (Malmuthuge et al., 2012) confirmado así la inmunocompetencia del ternero joven. Por esto se debe asegurar que los terneros a través de tubo esofágico consuman al menos 4 litros de calostro con ≥ 20% de inmunoglobulinas (Ig) sobre la base de materia seca –50 g de IgG en 1 litro que contiene 21% de materia seca– (Chelack et al., 1993) pues la capacidad absortiva intestinal de Ig empieza a disminuir 6 a 12 horas luego del nacimiento. Por esto, siempre se debe disponer de un banco de calostro –un 8% al 10% del peso corporal del ternero– con el fin de que en cada nacimiento se reserve un poco bien sea refrigerado o congelado. Los suplementos reemplazadores de calostro bovino deben contener una masa suficiente de Ig (> 120 g) en un volumen que un ternero normal podría ser esperado que consuma dentro de las 6 horas (< 2 L).
Aunque no existen vacunas específicas contra septicemia, la vacunación a vacas preñadas 6 meses antes del parto (Javappa et al., 2008) o 5 a 2 semanas antes del parto (K99, cepa mutante Rc J5 de E. coli, cepa mutante Re 17 de Salmonella Typhimurium) resulta en un incremento en las concentraciones de anticuerpos calostrales protectores y títulos de anticuerpos pasivos en terneros. Se puede suplementar a las vacas gestantes con inyecciones de Selenio y Vitamina E a fin de estimular la producción de mayor volumen de calostro (Lacetera et al., 1996). Dado que las Ig transferidas al ternero a través del calostro pueden causar supresión específica e inespecífica (disminuye la capacidad humoral del ternero) de la inmunidad neonatal, el momento ideal para inmunizar a un ternero es luego de la declinación de la concentración de Ig maternas cuando el sistema inmune tiene la madurez de generar una respuesta adecuada (Barrington & Parish, 2001).
Al nacer, el ombligo del ternero debe ser desinfectado con una solución de clorhexidina al 0,5% o con una solución de yodo del 1 al 2% pues puede contaminarse con patógenos que eventualmente podrían causar septicemia (Starost, 2001). El sitio de partos debe ser individual, limpio, libre de infecciones y de materia fecal, provisto de buen alimento y resguardado durante el tiempo de lluvias y preferiblemente con base de caucho. De igual modo, se deben reducir los factores de estrés (hacinamiento, calor o frío extremo, ventilación inadecuada, maltrato animal), mantener animales de la misma edad en un solo sitio. Los animales enfermos (o sospechosos de estarlo) se deben aislar en una unidad de cuarentena (Morley, 2002). Los materiales del establo así como los utensilios (dispositivos de alimentación, baldes) deben ser de fácil desinfección y resistentes a la corrosión. El peróxido de hidrógeno y el amonio cuaternario se recomiendan para el lavado de utensilios y equipos por su amplio espectro de acción así como al bisulfito de sodio para el piso y la cama (Calvo et al., 2010).
Conclusiones
La septicemia neonatal es una enfermedad multifactorial con baja tasa de supervivencia que afecta terneros de edad temprana. Un tratamiento antimicrobiano de amplio espectro y de soporte debe ser instaurado lo más pronto posible. Garantizar el consumo de calostro y mejorar las prácticas de manejo reduce el riesgo de presentación de la enfermedad. Futuras investigaciones son requeridas sobre el bloqueo de los TLRs (Coffey & Werling, 2011), el bloqueo o la reducción de la translocación nuclear del NF-кB (Shin et al., 2012), el inhibidor de neutrófilos polimorfonucleares como la CD14 recombinante bovina soluble (rbosCD14) (Wang et al., 2003), el etil-piruvato (Corl et al., 2010), la antitrombina III (AT-III), los antagonistas de factor agregador de plaquetas (tieno triazolo-diazepina) (Da Silva et al., 1997) o los péptidos animicrobianos (AMPs) como las temporinas (Mangoni & Shai, 2009; Wong & Luk, 2009) en terneros con septicemia adquirida en forma natural (en finca o en hospitales veterinarios) o inducida experimentalmente con animales control.
Referencias Bibliográficas
· Adams, J.L.; Semrad S.D.; Czuprynski, C.J. Administration of bacterial lipopolysaccharide elicits circulating Tumor necrosis factor-alpha in neonatal calves. Journal of Clinical Microbiology, v.28, n.5, p.998-1001, 1990. · Ajithdoss, K.; Porter, B.F.; Calise, D.V. et al. Septicemia in a neonatal calf associated with Chromobacterium violaceum. Veterinary Pathology, v.46, n.1, p.71-74, 2009. · Aldridge, B.M.; Garry, F.B.; Adams, R. Neonatal septicemia in calves: 25 cases (1985-1990). Journal of the American Veterinary Medical Association, v.203, n.9, p.1324-1329, 1993. · Andersen, P.; Jacobsen. S.; Tølbøll T. Dairy cows display significant inter-individual variation in clinical and haematological responses to lipopolysaccharides. In: XIII World Buiatrics Congress, 2004, Quebec City, Canada, Proceedings, July 11-16. · Ballou, M.A.; Cobb, C.J.; Hulbert, L.E. et al. Effects of intravenous dose on the pathophysiological response of colostrums-fed Jersey calves. Veterinary Immunology and Immunopathology, v.141, n.1-2, p.76-83, 2011. · Baquero-Parrado, J.R.; Fuentes-Reyes, E.E. Fluidoterapia en ganado bovino. Revista U.D.C.A., Actualización y Divulgación Científica, v.10, n.2, p.03-17, 2007. · Barrington, G.M.; Parish, S.M. Bovine neonatal immunology. Veterinary Clinics of North America Food Animal Practice, v.17, n.3, p.463-476, 2001. · Basoglu, A.; Sen, I; Sevinc, M. et al. Efficacy of sodium serum levels of tumor necrosis factor-α in neonatal calves with presumed septicemia. Journal of veterinary Internal Medicine, v.18, p.238-241, 2004. · Berchtold, J. Treatment of calf diarrhea: intravenous fluid therapy. Veterinary Clinics of North America, Food Animal Practice, v.25, n.3, p.73-99, 2009. · Besser, T.E.; Gay, C.C. Septicemic colibacilosis and failure of passive transfer of colostral immunoglobulin in calves. Veterinary Clinics of North America, Food Animal Practice, v.1, n.3, p.445-459, 1985. · Bieniek, K. Effect of duodenal glucose infusion on blood glucose concentration in endotoxin-treated calves. Zentralbl Veterinarmed A, v.45, n.8, p.481-490, 1998. · Biolatti, C.; Bellino, C.; Borrelli, A. et al. Sepsis and bacterial suppurative meningitis-meningoencephalitis in critically ill neonatal Piedmontese calves: clinical approach and laboratory findings. Schweizer Archiv für Tierheilkunde, v.154, n.8, p.239-246, 2012. · Bleul, L.; Bircher B.; Jud, R.S. et al. Respiratory and cardiovascular effects of doxapram and theophylline for the treatment of asphyxia in neonatal calves. Theriogenology, v.73, n.5, p.612-619, 2010. · Brown, M.P.; Mayo, M.B.; Gronwall, R.R. Serum and synovial fluid concentrations of ampicillin trihydrate in calves with suppurative arthritis. The Cornell Veterinarian, v.81, n.2, p.137-143, 1991. · Calvo, M.S.; Gerry, A.C.; McGarvey, J.A. et al. Acidification of calf bedding reduces fly development and bacterial abundance. Journal of Animal Science, v.93, n.3, p.1059-1064, 2010. · Chelack, B.J.; Morley, P.S.; Haines, D.M. Evaluation of methods for dehydration of bovine colostrum for total replacement of normal colostrum in calves. Canadian Veterinary Journal, v.34, n.7, p.407-412, 1993. · Cipolle, M.D.; Pascuale, M.D.; Cerra, F.B. Disfunción orgánica secundaria, desde las perspectivas clínicas hasta los mediadores moleculares. En: Clínicas de Terapia Intensiva. Buenos Aires, Argentina: Inter-Médica editorial, 1994. p.83-123. · Coffey, T.J.; Werling, D. Therapeutic targeting of the innate immune system in domestic animals. Cell and Tissue Research, v.343, n.1, p.251-261, 2011. · Constable, P.D. Acute endotoxemia increases left ventricular contractility and diastolic stiffness in calves. Shock, v.12, n.5, p.392-401, 1999. · Constable, P.D. Strong ion difference theory: a revolutionary approach to the diagnosis and treatment of acid-base abnormalities in cattle. In: XXV Jubilee World Buiatrics Congress 2008, Budapest, Hungary, Proceedings, p.28-33. · Constable, P.D. Treatment of calf diarrea. Antimicrobial and Ancillary treatments. Veterinary Clinics of North America, Food Animal Practice, v.25, n.1, p.101-120, 2009. · Constable, P.D.; Schmall, L.M.; Muir III, W.W. et al. Respiratory, renal, hematologic, and serum biochemical effects of hypertonic saline solution in endotoxemic calves. American Journal of Veterinary Research, v.52, n.7, p.990-998, 1991a. · Constable, P.D.; Schmall, L.M.; Muir III, W.W. et al. Hemodynamic response of endotoxemic calves to treatment with small-volume hypertonic saline solution. American Journal of Veterinary Research, v.52, n.7, p.981-989,1991b. · Constable, P.D. Critical Care for GastroIntestinal Diseases – IV therapy for electrolyte disorders. In: XVI Congreso Internacional de ANAMBE (Asociación Nacional de Especialistas en Medicina Bovina de España), Ávila, España, 11, 12 y 13 de Mayo, 2011a. · Constable, P.D. Antimicrobial and Ancillary Treatment of Calves With Diarrhea for Special Patients. In: 63rd Canadian Veterinary Medical Association Convention, Halifax, Nova Scotia, Canadá, July 6-9, 2011b. · Corl, C.M.; Robinson, H.R.; Contreras, G.A. et al. Ethyl pyruvate diminishes the endotoxin-induced inflammatory response of bovine mammary endothelial cells. Journal of Dairy Science, v.21, n.7, p.5188-5199, 2010. · Coskun, A.; Sen, I. The Importance of Acute Phase Protein Measurements in the Clinical Diagnosis of Calves Experimentally Induced with Lipopolisaccharide (E. coli) Endotoxemia -Calf Physiology, Management and Diseases-. In: XXV World Buiatrics Congress, 2008, Budapest, Hungary, Proceedings, p.231. · Da Silva, M.B.; Gustin, P.; Herion, F. et al. The effect of intravenous administration of WEB 2086 on PAF-induced platelet aggregation in healthy Friesian calves. Veterinary Research Communications, v.21, n.7, p.521-531, 1997. · Debey, M.; Blanchard, C.; Walker, R.L. Actinobacillus suis-like organisms associated with septicemia in neonatal calves. Journal of Veterinary Diagnostic Investigation, v.8, p.248-250, 1996. · Drago-Serrano, M.E.; De La Garza-Amaya, M; Luna, J.S. et al. Lactoferrin-lipopolysacharide (LPS) binding as key to antibacterial and endotoxic effects. International Journal of Immunopharmacology, v.12, n.1, p.1-9, 2012. · Eades, S.C. Endotoxemia in dairy cattle: role of eicosanoids in reticulorumen stasis. Journal of Animal Science, v.76, n.2, p.414-420, 1993. · Fairbrother, J.M. Escherichia coli Infections in Farm Animals. In: Howard, J.L. Current Veterinary Therapy Food Animal Practice. 3.ed. Philadelphia, USA: · Fecteau, G.; George L. Central Nervous System infection and Infestation. In: Anderson, D. & Rings, D. Current Veterinary Therapy Food Animal Practice. 5.ed. St. Louis, Missouri, USA: Saunders Elsevier, 2009. p.312-314. · Fecteau, G.; Van Metre, D.C.; Pare, J. et al. Bacteriological culture of blood from critically ill neonatal calves. Canadian Veterinary Journal, v.38, n.2, p.95-100, 1997a. · Fecteau, G.; Van Metre, D.C.; Pare, J. et al. Use of a clinical sepsis score for predicting bacteremia in neonatal dairy calves on a calf rearing farm. Canadian Veterinary Journal, v.38, n.2, p.101-104, 1997b. · Fecteau, G.; Fairbrother, J.M.; Higgins, R. et al. Virulence factors in Escherichia coli isolated from the blood of bacteremic neonatal calves. Veterinary Microbiology, v.78, n.3, p.241-249, 2001. · Fecteau, G.; Smith B.P.; George, L.W. Septicemia and Meningitis in the Newborn Calf. The Veterinary Clinics of North America, Food Animal Practice, v.25, n.1, p.195-208, 2009. · Fecteau, M.E.; Palmer, J.E.; Wilkins, P.E. Neonatal Care of High/Risk Cloned and Transgenic Calves. Veterinary Clinics of North America, Food animal Practice, v.21, n.3, p.637-653, 2005. · Fraipont, J.L.; Houffschmitt, P.; Viguerie, Y. Cefquinome in the treatment of septic arthritis in calves. In: XXII World Buiatrics Congress, 2002, Hannover, Germany, Proceedings, p.268-699. · Francoz, D.; Desrochers, A.; Fecteau, G. et al. Synovial fluid changes in induced infectious arthritis in calves. Journal of Veterinary Internal Medicine, v.19, n.3, p.336-343, 2005. · Fu, Y.; Liu, B.; Feng, X. et al. Lipopolysaccharide increases Toll-like receptor 4 and downstream Toll-like receptor signaling molecules expression in bovine endometrial epithelial cells. Veterinary Immunology Immunopathology, v.151, n.1-2, p. 20-27, 2013. · Genicot, B.; Close, R.; Lindsey, J.K. et al. Pulmonary function changes induced by three regimens of bronchodilating agents in calves with acute respiratory distress syndrome. Veterinary Record, v.137, n.8, p.183-186, 1995. · Gerros, T.C.; Semrad, S.D.; Proctor, R.A., et al. Effect of dose and method of administration of endotoxin on cell mediator release in neonatal calves. American Journal of Veterinary Research, v.12, n.54, p.2121-2127, 1993. · Ghanbarpour, R.; Oswald, E. Characteristics and virulence genes of Escherichia coli isolated from septicemic calves in southeast of Iran. Tropical Animal Health Production, n.41, n.7, p.1091-1099, 2009. · Godson, D.L.; Acres, S.D.; Haines, D.M. Failure of passive transfer and effective colostrum management in calves. Large Animal Veterinary Rounds, v.3, n.10, 2003. · Green, S.L.; Smith, L.L. Meningitis in neonatal calves: 32 cases (1983-1990). Journal of the American Veterinary Medical Association, v.201, n.1, p.125-128, 1992. · Guatteo, R.; Bonnier, M.; Swinkels, J. Diffusion of cefquinome in tarsal joints experimentally infected with E. Coli. In: XXVI World Buiatrics Congress, 2010, Santiago de Chile, Chile, Proceedings, Nov. 14-18. · Haerdi-Landerer, M.C.; Suter, M.M.; Steiner, A. Intra-articular administration of doxycycline in calves. American Journal of Veterinary Research, v.68, n.12, p.1324-1331, 2007. · Hariharan, H. ; Bryenton, J. ; Onge, J. et al. Blood cultures from calves and foals. Canadian Veterinary Journal, v.33, n.1, p.56-57, 1992. · Hunt, E.; Wood, B. Use of blood and blood products. Veterinary Clinics of North America, Food Animal Practice, v.15, n.3, p.641-662, 1999. · Ibeagha-Awemu, E.M.; Lee, J.W.; Ibeagha, A.G. et al. Bacterial lipopolysaccharide induces increased expression of toll-like receptor (TLR) 4 and downstream TLR signaling molecules in bovine mammary epithelial cells. Veterinary Research, v.39, n.2, p.11, 2008. · Irmak, K.; Sen, I.; Cöl, R. et al. The evaluation of coagulation profiles in calves with suspected septic shock. Veterinary Research Communications, v.30, n.5, p.497-503, 2006. · Jacobsen, S.; Heegaard, P.M.H., Tølbøll, T.H. et al. Bovine endotoxicosis: individual variation in clinical symptoms and their relation to the acute phase response. In: XXII World Buiatric Congress, 2002, Hannover, Germany, Proceedings, August 18-23. · Javappa, H.; Davis, R.; Dierks, L. et al. Demonstration of passive protection in neonatal calves against colibacillosis following immunization of pregnant heifers at 3 months of gestation. Veterinary Therapeutics: Research in Applied Veterinary Medicine, v.9, n.4, p.283-289, 2008. · Jolly, S.; Thomas, C.; Genicot, B. et al. Effect of intravenous platelet-activating factor on bovine pulmonary mast cells. Journal of Comparative Pathology and Therapeutics, v.125, n.2-3, p.81-89, 2001. · Kenison, D.C.; Elsasser, T.H.; Fayer, R. Tumor necrosis factor as a potential mediator of acute metabolic and hormonal responses to endotoxemia in calves. American Journal of Veterinary Research, v.52, n.8, p.1320-1326, 1991. · Kiluge, J.P.; Perl, S. Erysypelothrix rhusuipathiae septicemia- polyseroditis and streptococcal encephalitis in a calf. Journal of Veterinary Diagnostic Investigation, v.4, n.2, p.196-197, 1992. · Kinsbergen, M.; Bruckmaier, R.M.; Blum, J.W. Metabolic, endocrine and haematological responses to intravenous E. coli endotoxin administration in 1-week-old calves. Zentralbl Veterinarmed A, v.41, n.7, p.530-547, 1994. · Kireçci, E.; Ozkanlar, Y.; Aktas, M.S. et al. Isolation of pathogenic aerobic bacteria from the blood of septicaemic neonatal calves and the susceptibility of isolates to various antibiotics. Journal of the South African Veterinary Association, v.81, n.2, p.10-113, 2010. · Koot, R. Enfermedades infecciosas: mecanismos patogénicos y respuestas del huésped. En: Smith L. & Thier S. Fisiopatología: principios biológicos de la enfermedad. 2.ed. Buenos Aires, Argentina: Editorial Médica Panamericana, 1993. p.164. · Lacetera, N.; Bernabucci, U.; Ronchi, B. et al. Effects of selenium and vitamin E administration during a late stage of pregnancy on colostrum and milk production in dairy cows, and on passive immunity and growth of their offspring. American Journal of Veterinary Research, v.57, n.12, p.1776-1780, 1996. · Lavon, Y.; Leitner, G.; Goshen, T. et al. Exposure to endotoxin during estrus alters the timing of ovulation and hormonal concentrations in cows. Theriogenology, v.70, n.6, p.956-967, 2008. · Little, P.B. Haemophilus somnus Complex: pathogenesis of the septicemic Thrombotic meningoencephalitis. Canadian Veterinary Journal, v.27, n.2, p.94-96, 1986. · Lofstedt, J.; Dohoo, I.R.; Duizer, G. Model to predict Septicemia in Diarrheic Calves. Journal of Veterinary Internal Medicine, v.13, n.2, p.81-88, 1999. · Malmuthuge, N.; Li, M.; Fries, P. et al. Regional and age dependent changes in gene expression of Toll-like receptors and key antimicrobial defence molecules throughout the gastrointestinal tract of dairy calves. Veterinary Immunology Immunopathology, v.146, n.1, p.18-26, 2012. · Mangoni, M.L.; Shai, Y. Temporins and their synergism against Gram-negative bacteria and in lipopolysaccharide detoxification. Acta Biochimica et Biophysica Sinica, v.1788, n.8, p.1610-619, 2009. · McGill, J.L.; Nonnecke, B.J.; Lippolis, J.D. et al. Differential chemokine and cytokine production by neonatal bovine γδ T cell subsets in response to viral toll-like receptor agonists and in vivo RSV infection. Immunology, doi: 10.1111/imm.12075, “en prensa”, Jan 31, 2013. · Mohamed Ou Said, A.; Contrepois, M.G.; Der Vartanain, M. et al. Virulence factors and markers in Escherichia coli from calves with bacteremia. American Journal of Veterinary Research, v.49, n.10, p.1657-1660, 1988. · Morley, S.P. Biosecurity of Veterinary Practices. Veterinary Clinics of North America Food Animal Practice, v.18, n.1, p.133 -155, 2002. · Müller, K.R.; Gentile, A.; Klee, W. et al. Importance of the Effective Strong Ion Difference of an Intravenous Solution in the Treatment of Diarrheic Calves with Naturally Acquired Acidemia and Strong Ion (Metabolic) Acidosis. Journal of Veterinary Internal Medicine, v.26, n.3, p.674-683, 2012. · Munroe, G.A.; Cauvin, E.R. The use of arthroscopy in the treatment of septic arthritis in two Highland calves. The British Veterinary Journal, v.150, n.5, p.439-449, 1994. · Nagy, D.W. Resuscitation and Critical care of neonatal calves. In: CVC. Proceedings, Kansas City, USA, 2009. August 1. · Nazifi, S.; Rezakhani, A.; Badran, M. Evaluation of hematological, serum biochemical and cerebrospinal fluid parameters in experimental bacterial meningitis in the calf. Zentralblatt für Veterinärmedizin. Reihe A, v.44, n.1, p.55-63, 1997. · Ohtsuka, H.; Higuchi, T.; Matsuzawa, H, et al. Inhibitory effect on LPS-induced tumor necrosis factor in calves treated with chlorpromazine or pentoxifylline. The Journal of Veterinary Medical Science, v.59, n.11, p.1075-1077, 1997. · Olson, N.C.; Hellyer, P.W.; Dodam, J.R. Mediators and vascular effects in response to endotoxine. British Veterinary Journal, v.151, n.5, p.498-522, 1995. · Oviedo-Boyso, J.; Díaz-Pérez, I.; Bravo-Patiño, A. et al. La activación del factor nuclear kappa B (NF-кB) afecta la internalización y supervivencia intracelular de Staphylococcus aureus y Staphylococcus epidermidis en células endoteliales de bovino. Ciencia Nicolaita, n.47, p.85-102, 2007. · Peek, S.F.; Apple, F.S.; Murakami, M.A. et al. Cardiac isoenzymes in healthy Holstein calves and calves with experimentally induced endotoxemia. Canadian Veterinary Journal, v.72, n.4, p.365-361, 2008. · Pérez-García, J.A. Practitioner's views on fluid therapy in calves. Veterinary Clinics of North America, Food Animal Practice, v.15, n.3, p.533-543, 1999. · Petersen, H.H.; Nielsen, J.P.; Heegaard, P.M. Application of acute phase protein measurements in veterinary clinical chemistry.Veterinary Research, v.35, n.2, p.163-187, 2004. · Raboisson, D.; Clement, J.; Queney, N. et al. Detection and bacteremia in newborn calves by catalase-based urine test. Journal of Veterinary Internal Medicine, v.24, n.6, p.1532-1536, 2010. · Ravary-Plumioën, B. Resuscitation procedures and life support of the newborn calf. Revue Médecine Vétérinaire, v.8-9, n.160, p.410-419, 2009. · Rea, D.E.; Tyler, J.W.; Hancock, D.D. et al. Prediction of calf mortality by the uses of tests for passive transfer of colostral immunoglobulin. Journal of the American Veterinary Medical Association, v.208, n.12, p.2047-2049, 1996. · Rohde, C.; Anderson, D.E.; Desrochers, A. et al. Synovial fluid analysis in cattle. Veterinary Surgery, v.29, n.4, p.341-346, 2000. · Roussel, A.J.; Withney, M.S.; Cole, D.J. Interpreting a bovine serum chemistry profile. Part 2. Veterinary Medicine, v.92, n.6, p.559-566, 1997. · Samad, M.A.; Islam, M.A.; Hossain, K.A. et al. Haemato-biochemical changes and antibiotic sensitivity to Escherichia coli associated with concurrent enteric and septicaemic infection in calves. Bangladesh Journal of Veterinary Medicine, v.1, n.1, p.39-43, 2003. · Santos, R.L.; Tsolis, M.R.; Bäumler, A.J. et al. Hematologic and serum biochemical changes in Salmonella ser Typhimurium-infected calves. American Journal of Veterinary Research, v.63, n.8, p.1145-1150, 2002. · Schneberger, D.; Lewis, D.; Caldwell, S. et al. Expression of toll-like receptor 9 in lungs of pigs, dogs and Cattle. International Journal of Experimental Pathology, v.92, n.1, p.1-7, 2011. · Schroedl, W.; Fuerll, B.; Reinhold, P. et al. A novel acute phase marker in cattle Lipopolysacharide binding protein (LBP). Journal of Endotoxin Research, v.7, n.1, p.49-52, 2001. · Seabury, C.M.; Cargill, E.J.; Womack, J.E. Sequence variability and protein domain architectures for bovine Toll-like receptors 1, 5, and 10. Genomics, v.90, n.4, pp.502-515, 2007. · Seabury, C.M.; Seabury, P.M.; Decker, J.E., et al. Diversity and evolution of 11 innate immune genes in Bos taurus taurus and Bos taurus indicus cattle. Proceedings of the National Academy of Sciences of United States of America, v.107, n.1, p.151-156, 2010. · Seimiya, Y.; Ohshima, K.; Itoh, H, et al. Listeric septicemia with meningitis in a neonatal calf. Journal of Veterinary Medical Science, v.54, n.6, p.1205-1207, 1992. · Semrad, S.D. Comparison of flunixin, prednisolone, dimethyl sulfoxide, and a lazaroid (U74389F) for treating endotoxemic neonatal calves. American Journal of Veterinary Research, v.54, n.9, p.1517-1522, 1993a. · Semrad, S.D. Comparative efficacy of flunixin, ketoprofen, and ketorolac for treating endotoxemic neonatal calves. American Journal of Veterinary Research, v.54, n.9, p.1511-1516, 1993b. · Semrad, S.D.; McClure, J.T.; Sams, R.A. et al. Pharmacokinetics and effects of repeated administration of phenylbutazone in neonatal calves. American Journal of Veterinary Research, v.54, n.11, p.1906-1912, 1993. · Shin, J.S.; Park, S.J.; Ryu, S. et al. Potent anti-inflammatory effect of a novel furan-2,5-dione derivative, BPD, mediated by dual suppression of COX-2 activity and LPS-induced inflammatory gene expression via NF-кB inactivation. British Journal of Pharmacology, v.165, n.6, p.1926-1940, 2012. · Smith, G.W. Supportive Therapy of the Toxic Cow. Veterinary Clinics of North America, Food Animal Practice, v.21, n.3, p.595-614, 2005. · Smith, S.A.; Jann, O.C.; Haig, D. et al. Adaptive evolution of Toll-like receptor 5 in domesticated mammals. BMC Evolutionary Biology, v.12, n.1, p.122, 2012. · Staempfli, H.R. Role of electrolytes in acid-base balance: theory and practicality. American College Veterinary Internal Medicine Forum, 2005, Baltimore, USA, Electronic Proceedings. · Starost, M.F. Haemophilus somnus isolated fron urachal abcess in a calf. Veterinary Pathology, v.38, n.5, p.547-548, 2001. · Stöber, M. Viremia, bacteremia, septicemia, toxemia. Enfermedades de la sangre. In: Gerrit-Dirksen, Hans-Dieter Gründer, Matthaeus Stöber. 4.ed. Medicina Interna y Cirugía del Bovino. Buenos Aires, Argentina: Inter-Médica editorial, 2005. p.197. · Stokol, T.; Divers, T.J.; Arrigan, J.W. et al. Cerebrospinal fluid findings in cattle with central nervous system disorders: a retrospective study of 102 cases (1990-2008). Veterinary Clinical Pathology, v.38, n.1, p.103-112, 2009. · Sun, L.; Song, Y.; Riaz, H. et al. Polymorphisms in toll-like receptor 1 and 9 genes and their association with tuberculosis susceptibility in Chinese Holstein cattle. Veterinary Immunology Immunopathology, v.147, n.3-4, p.195-201, 2012. · Svensson, C.; Lundborg, K.; Emanuelson, U. et al. Morbidity in Swedish dairy calves from birth to 90 days of age and individual calf-level risk factors for infectious diseases. Preventive Veterinary Medicine, v.58, n.3-4, p.179-197, 2003. · Thomas, E.; Roy, O.; Skowronski, V. et al. Comparative field efficacy study between cefquinome and gentamicin in neonatal calves with clinical signs of septicaemia. Revue Médecine Vétérinaire, v.10, n.155, p.489-493, 2004. · Vaala, W.E.; House, J.K. Neonatal infection. In: Smith. B.P. (ed). Large Animal Internal Medicine. 3.ed. St Louis, USA: Mosby, 2002. p.303-318. · Vaala, W.; House, J.; Lester G. Infección Neonatal. In: Smith B.P. (ed.). Medicina Interna de Grandes Animales. 4.ed. Barcelona: Elsevier España, 2010. p.281-292. · Van Dokersgoed, J.; Janzen, E.D.; Harland, R.J. Epidemiological features of calf mortality due to hemophilosis in a large feedlot. Canadian Veterinary Journal, v.31, n.12, p.821-825, 1990. · Vincent, J.L.; Roman, A.; Kahn, R.J. Dobutamine administration in septic shock: addition to a standard protocol. Critical Care Medicine, v.18, n.7, p.689-693, 1990. · Wang, Y.; Zarlenga, D.S.; Paape, M.J. et al. Functional analysis of recombinant bovine CD14. Veterinary Research, v.34, n.4, p.413-421, 2003. · Weaver, D.M.; Tyler, J.W.; Van Metre, D.C. et al. Passive transfer of colostral immunoglobulins in calves. Journal of Veterinary Internal Medicine, v.14, n.6, p.569-577, 2000. · White, S.N.; Kata, S.R.; Womack, J.E. Comparative fine maps of bovine toll-like receptor 4 and toll-like receptor 2 regions. Mammalian Genome, v.14, n.2, p.149-155, 2003. · Wong, K.F.; Luk, J.M. Endotoxin-neutralizing peptides as gram-negative sepsis therapeutics. Protein and Peptide Letters, v.16, n.5, p.539-542, 2009.
Como citar: Baquero-Parrado, J. R. Evaluación clínica y tratamiento de la septicemia neonatal bovina. Revista Veterinaria y Zootecnía 6(2) p.89-111.
<http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=152> |