|
Cinética de fermentación de Lactobacillus plantarum en un medio de cultivo enriquecido como potencial probiótico*
ARTÍCULO DE
(Recibido: septiembre 23, 2013 Aprobado: noviembre 21, 2013 Actualizado: diciembre 20, 2013)
RESUMEN: El objetivo fue determinar la cinética de crecimiento de Lactobacillus plantarum en medio de cultivo enriquecido como potencial probiótico. Las cepas de L. plantarum 1 fueron probadas con el medio comercial MRS; y con 10 g/L azúcar blanco, 15 g/L leche de soya, 150 g/L suero de leche, 15 g/L salvado de trigo (Medio 4). Las variables evaluadas durante la cinética fueron: determinación de pH, viabilidad en placa (UFC/ml), determinación de azúcar total, determinación de la producción de ácidos orgánicos, y evaluación de la producción de biomasa. Los mejores resultados para viabilidad en el Medio 4 (M4) fueron para L. plantarum 1 H1 y L. plantarum 1 H2 con valores de 3,0 x 1012 y 6,0 x 1011 UFC/ml a las 12 horas de efectuada la cinética. La evolución de pH final fue de 4,21 y 4,07 respectivamente para cada cepa. El azúcar total y la producción de ácido láctico en el Medio 4 para L. plantarum 1 H1 presentó valores de 8,90 g/L y de 17,66 g/L respectivamente. Para L. plantarum 1 H2 presentó valores de 10,8 g/L y de 13,16 g/L respectivamente. Durante el proceso de fermentación efectuado, las dos cepas evaluadas alcanzaron los valores mayores de μh-1. Sin embargo, es de tener en cuenta que entre las dos bacterias la mejor μh-1 se presentó en L. plantarum 1 H1 y por tanto, el tiempo de duplicación celular es menor. L. plantarum 1 en el Medio 4 indicó ser óptimo como inóculo probiótico que podría ser evaluado en lechones como alternativa al uso de antibióticos.
Palabras clave: antibióticos, biomasa, inóculo, funcional
Fermentation kinetics of Lactobacillus plantarum at a rich culture medium as a potential probiotic
ABSTRACT: The objective to determine the kinetics of growth of Lactobacillus plantarum in culture medium enriched as potential probiotic. The strains of L. plantarum 1 were tested with MRS commercial medium, and 10 g/L white sugar, 15 g/L soy milk, 150 g/L whey, 15 g/L wheat bran (Medium 4). The variables were evaluated during the kinetics: determination of pH, plaque viability (CFU/ml), determination of total sugar, determination of organic acid production, and evaluation of biomass production. The best results for viability in the medium 4 (M4) were for L. plantarum 1 H1 and L. plantarum 1 H2 with values of 3.0 x 1012 and 6.0 x 1011 CFU/ml at 12 hours made the kinetics.The evolution of final pH was 4.21 and 4.07 respectively for each strain. The total sugar and lactic acid production in the medium 4 for L. plantarum 1 H1 showed values of 8.90 g/L and 17.66 g/L. For L. plantarum 1 H2 showed values of 10.8 g/L and 13.16 g/L respectively. During the fermentation process carried the two strains tested reach values greater than ofμh-1. However, it is of note that between the two bacteria the best μh-1 was introduced in L. plantarum 1 H1 and hence, the cell doubling time is lower. L. plantarum 1 on the medium 4 shown to be optimal as probiotic inoculums can be evaluated in piglets as an alternative to antibiotics.
Key words: antibiotics, inoculum, biomass, functional
Introducción
Los Lactobacillus tienen un metabolismo fermentativo, son principalmente aerotolerantes y otras especies son estrictamente anaeróbicas. El crecimiento se da a un pH de 4,5-5,8. Son exigentes en cuanto a aminoácidos, péptidos, nucleótidos, vitaminas, minerales, ácidos grasos y carbohidratos. Se clasifican en homolácticos y heterolácticos con base en la vía de fermentación que utilizan. En condiciones de exceso de glucosa y un limitado uso de oxígeno, los homolácticos transforman un mol de glucosa a través de la vía glucolítica de Embden-Meyerhof-Parnas para formar dos moles de piruvato. El balance redox intracelular se mantiene por la oxidación de NADH con la concomitante reducción del piruvato en ácido láctico. Este proceso genera dos moles de ATP por cada mol de glucosa consumida. Los representantes de las Bacterias Ácido Lácticas (BAL) homolácticas y heterolácticas incluyen Lactococcus, Enterococcus, Streptococcus, Pediococcus y el grupo I Lactobacilli (Axelsson, 2004). En la producción animal el género Lactobacillus, ha sido utilizado en lechones destetos para prevenir desordenes en el tracto gastrointestinal, como es el caso de la diarrea, promover el crecimiento, estimular la inmunidad protectora contra patógenos y aumentar la respuesta inmune de la mucosa intestinal. El objetivo de este trabajo fue determinar la cinética de crecimiento de Lactobacillus plantarum en medio de cultivo enriquecido como potencial probiótico.
Materiales y Métodos
El presente estudio se realizó en los laboratorios de Microbiología y en los laboratorios de Biocatálisis y Fermentación de la Escuela de Ingeniería de Alimentos de la Universidad del Valle, sede Meléndez, Cali, Colombia.
Inicialmente la reconstitución de la cepa se realizó utilizando un agar nutritivo (Nutrient Agar) marca OXOID CM0003 de 500 g, elaborado por OXOID LTD, Basingstoke, Hampshire, England, el cual se preparó de acuerdo a las instrucciones indicadas. Como paso siguiente, a las 24 horas se procedió a la reconstitución de la cepa de acuerdo a las instrucciones para Microorganismos KWIK-STIK™.
Posteriormente, se confirmó su crecimiento y se pasó a realizar el repique en cajas con agar MRS comercial, por el método de estrías y se incubó por 24 horas a 35°C. Este procedimiento se realizó en cámara de flujo laminar tipo II, para evitar contaminación del medio.
Al día siguiente, se revisó nuevamente su crecimiento en el agar MRS para constatar su morfología tanto macroscópica como microscópicamente y mediante tinción de Gram se confirmó su pureza. Para la conservación de la cepa se realizó cada cinco días en medio sólido en agar MRS y cada ochos días en caldo MRS, estos preservados se incubaron por 20-24 horas a 35-37°C y se almacenaron refrigerados en nevera a 4°C. Asimismo, cada vez que se realizó un nuevo repique o siembra se confirmó su pureza mediante tinción de Gram.
Posteriormente, se inoculó una alícuota de la cepa en un erlenmeyer que contenía 40 ml de caldo MRS comercial estéril. Se incubó por 24 h a 35°C. Nuevamente se realizó un repique de 4 ml de esta en caldo a otros 40 ml de caldo MRS comercial y se incubó en las condiciones antes mencionadas.
Según Crueger & Crueger (1993), el porcentaje de inóculo se debe ajustar al 10% v/v, para iniciar la fermentación. Para esto, se prepararon 90 ml de caldo MRS estéril y se adicionaron 10 ml del inóculo probiótico aplicando la regla. Después de este tiempo se calculó el número de bacterias por ml.
Del caldo MRS comercial con el inóculo se tomó 1 ml y se hizo lectura directa en espectrofotómetro a 625 nm, cuando se presentó mayor población de la establecida se adicionó caldo estéril teniendo en cuenta el siguiente cálculo matemático de proporcionalidad de acuerdo a Guerrero (apud Montes et al., 2003):
M1 = población o densidad celular que se debe ajustar
Enseguida, las cepas de L. plantarum 1 H1 y L. plantarum 1 H2 aisladas microbiológicamente del intestino grueso de cerdos fueron probadas con cuatro medios de cultivo seleccionados con la siguiente composición: Medio comercial MRS (Medio 1); 20 g/L azúcar blanco, 14 g/L leche de soya, 130 g/L suero de leche, 30 g/L salvado de trigo (Medio 2); 15 g/L azúcar blanco, 12 g/L leche de soya, 120 g/L suero de leche, 10 g/L salvado de trigo (Medio 3); 10 g/L azúcar blanco, 15 g/L leche de soya, 150 g/L suero de leche, 15 g/L salvado de trigo (Medio 4).
Estos medios fueron evaluados mediante cinéticas de fermentación (Ramírez, 2005) que se efectuaron en un erlenmeyer de 200 ml a 32°C, en agitación constante en shaker. Los parámetros evaluados fueron: evolución del pH, viabilidad en Unidades Formadoras de Colonia por mililitro (UFC/ml), consumo de azúcar y producción de ácidos orgánicos. Las mediciones o toma de muestras se realizaron cada tres horas durante 24 horas.
Se realizó comparando el Medio comercial (MRS) para el crecimiento de las Bacterias Ácido Lácticas (BAL) con los resultados obtenidos de células viables, pH y el costo de elaboración de un litro de este Medio comercial comparado con el costo de la materia prima para la producción de un litro de inóculo con el Medio 4.
Se verificó mediante la medición en pHmetro [Modelo digital Atronix 4801 (40HP), New York, USA]; indicando la producción de ácidos orgánicos cuantificados por HPLC y relacionados con el conteo de viabilidad.
El análisis de producción de ácidos orgánicos se realizó por cromatografía líquida de alta eficiencia (HPLC), permitiendo caracterizar las bacterias en homo o heterofermentativas, estableciendo un perfil característico para cada especie (Brizuela, 2003), descartando fácilmente cepas con perfiles idénticos. El caldo de crecimiento se centrifugó a 8500 rpm, filtrando el sobrenadante por membrana de 0,45 m. Los ácidos orgánicos fueron determinados por HPLC así: solvente de fase móvil, ácido sulfúrico a pH 1,5; presión 800-900 PSI; volumen inyectado: 20 L; temperatura del horno: 65ºC; columna BIORAD aminex HPX87 H con soporte de resina trasplantada H+ (copolímero de estireno y bisulfato dedivinilbenzeno).
El conteo de microorganismos viables en placa UFC/ml, permitió determinar la producción de biomasa. No se efectuaron medidas por peso seco ni por turbidimetría debido a las elevadas cantidades de sólidos en suspensión del medio de cultivo. Para los conteos se diluyó 1 ml de muestra en 9 ml de agua peptonada al 0,1% y se hicieron diluciones decimales; de cada dilución se transfirió a cajas de Petri con Medio MRS con azul de anilina 0,1 ml para siembra en superficie. Las cajas fueron incubadas a 32°C y observadas entre las 24 y 48 horas. Se consideraron las cajas de Petri con conteos de UFC/ml entre 30 y 300 colonias. El número de colonias fue multiplicado por el inverso de la dilución y por 10 para obtener las UFC/ml.
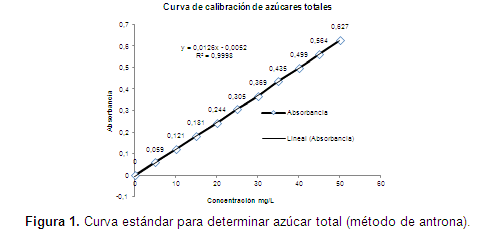
La determinación de azúcar total, permitió determinar el consumo para el crecimiento de los microorganismos y establecer la relación de consumo/crecimiento celular. Los azúcares fueron determinados por el método de Dubois et al. (1956), conocido por el método de antrona. Se preparó previamente una curva patrón con diferentes concentraciones de la solución patrón glucosa; los valores obtenidos de la lectura de densidad óptica (D.O.) a 525 nm. Se graficaron versus la concentración en mg/L y se obtuvo la ecuación de la recta.
La dosificación de los azúcares presentes en las muestras en estudio fue efectuado sobre 2,5 ml de muestra previamente diluida en agua destilada y adicionados 5 ml de antrona preparada en ácido sulfúrico. Los valores obtenidos de las muestras se calcularon por la ecuación de la recta, obtenidos en la curva patrón y multiplicados por el factor de dilución.
La evaluación de la síntesis de ácidos orgánicos se llevó a cabo siguiendo las mismas condiciones descritas anteriormente en el método de diferenciación de cepas por la producción de ácidos orgánicos.
Los resultados obtenidos de la evaluación de biomasa permitieron determinar las cepas que resultaron ser las más adecuadas en términos tiempo-tasa de crecimiento durante el proceso de fermentación para establecer el tiempo de duración en la producción de biomasa.
Los cálculos de fermentación para las cinéticas son los definidos por Crueger & Crueger (1993) y Rodríguez et al. (2004). La velocidad específica de crecimiento definida por la ecuación tiempo de duplicación celular. Siendo la velocidad específica de crecimiento definida por la ecuación:
V max = dln X / dt
Los datos se analizaron usando un diseño experimental con estructura factorial 2 x 2 en bloques completamente al azar, con la siguiente fórmula matemática:
Yijk = U + Ai + Bj + Cij + (ABij) + eij, donde:
La variable medida fue las UFC/ml. El análisis estadístico sobre la viabilidad obtenida de los microorganismos (UFC/ml) para L. plantarum 1 H1 y L. plantarum 1 H2 en dos medios distintos se hizo a lo largo de 5 estados de tiempo (tomados en un periodo de 24 horas), para observar mejor su crecimiento, de esta manera, los tiempos fueron tomados con intervalo de 6 horas. Las UFC/ml se trabajaron bajo transformación logarítmica.
Resultados y Discusión
En el estudio se presentaron los mejores resultados para la viabilidad en el Medio 4 (M4) para L. plantarum 1 H1 y L. plantarum 1 H2 con valores de 1,0 x 1013 y 4,0 x 1014 UFC/ml. La evolución de pH final fue de 3,75 y 3,70 respectivamente para cada cepa.
Estos resultados son mejores que los presentados en el Medio comercial MRS, en el cual L. plantarum 1 H1 y L. plantarum 1 H2 mostraron viabilidades de 1,0 x 108 y 4,0 x 1012 UFC/ml. De igual manera, los valores finales de pH fueron de 3,94 y 3,80.
Por lo anterior, se seleccionó el Medio 4 para los diferentes ensayos de cinética. El menor pH presentado para las dos cepas en el Medio 4 se debió probablemente a una mayor producción de ácido láctico durante el crecimiento, siendo esta una característica importante de L. plantarum (Zamudio & Zavaleta, 2003). La concentración celular alcanzada en el Medio 4 para los dos microorganismos, es considerada como óptima de 108 y 109 UFC/g (Kaban & Kaya, 2006), indicando ser adecuados en la preparación de inóculos con propiedades probióticas. Zamudio & Zavaleta (2003), afirman que entre los Lactobacillus que presentan buenas características como potenciales bacterias probióticas (resistencia a pH 3 y 0,3% de bilis), se encuentra el L. plantarum.
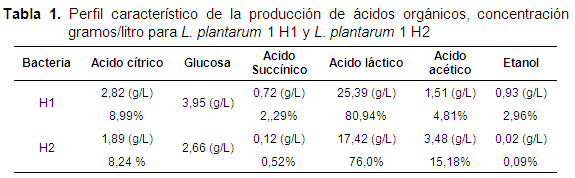
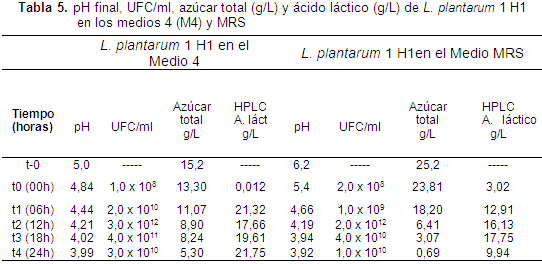
La prueba por HPLC indicó que las cepas de L. plantarum 1 H1 y H2 eran homofermentivas, presentando una producción de ácido láctico superior al 75% (Tabla 1), el cual podría contribuir a disminuir el pH del medio y actuar como inhibidor de microorganismos patógenos (Ramírez, 2005). El 25% restante se evidenció que correspondía a ácido cítrico, ácido succínico, ácido acético, glucosa y etanol. Tabla 1
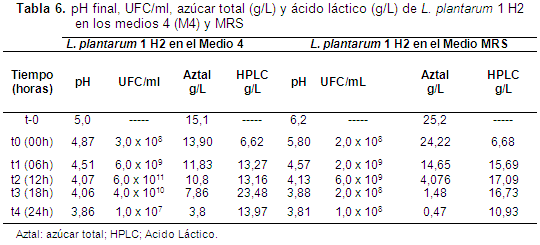
L. plantarum 1 H1 en los medios M4 y MRS, presentó el máximo crecimiento (UFC/ml) a las 12 horas de la cinética, es decir, al alcanzar la fase exponencial de crecimiento, con valores de 3,0 x 1012 UFC/ml y de 2,0 x 1012 UFC/ml respectivamente, con una pequeña ventaja para el Medio 4. En el caso de L. plantarum 1 H2 en los medios 4 y MRS, obtuvo el máximo crecimiento (UFC/ml) a las 12 horas de la cinética, con unos valores de 6,0 x 1011 UFC/ml y de 6,0 x 109 UFC/ml respectivamente, con una ventaja para el Medio 4.
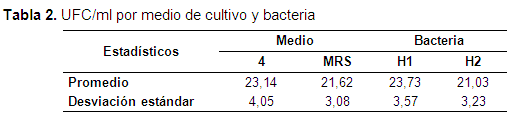
La Tabla 2, describe la viabilidad (UFC/ml) en los 2 medios de cultivos y las 2 bacterias usadas, evidenciando poca diferencia entre bacterias y entre medios de cultivo a lo largo del tiempo de crecimiento. Sin embargo, L. plantarum 1 H1 en el medio de cultivo 4 presentó en promedio un crecimiento mayor. Para el medio de cultivo 4, los resultados de UFC/ml presentan mayor variabilidad con respecto a la media producida por el efecto de las dos bacterias en este sustrato, es decir, la variabilidad presentada para el Medio 4 es superior al Medio MRS. Los dos microorganismos presentaron similar variabilidad con respecto al promedio generado para los dos medios de cultivo, pero se observa, que la bacteria que presenta mayor desarrollo de UFC/ml es L. plantarum 1 H1. Esto permite una eficiente colonización en la mucosa intestinal y la adhesión mediante la unión de manosa en células de la mucosa. Esta acción se explica por la fermentación de azúcares y fibras del sustrato (para esta investigación el Medio 4), preferido para enterocitos, los ácidos grasos de cadena corta. Esto es muy importante ya que gracias a este hecho, L. plantarum 1 contribuye a la exclusión de otras bacterias para adherirse, reduciendo la translocación y la inflamación intestinal; además, de estimular la producción de mucinas en las células HT-29 in vitro (Mack et al., 2003).
Mediante la cinética el tiempo requerido para obtener el máximo crecimiento microbiano en los medios 4 y MRS fue de 12 horas, coincidiendo con los encontrados por Ramírez (2005), quien obtuvo mayor crecimiento con L. plantarum, con 12 horas de proceso y en un medio igual a la del Medio 4 utilizado en esta investigación, y con un incremento celular de 9,6 x 1011 UFC/ml y 8,2 x 1011 UFC/ml respectivamente, señalando que el tiempo mínimo de duración del proceso fermentativo con utilización de estos medios fue de 12 horas. De igual manera, esta autora encontró que el medio MRS presentó una leve desventaja comparada con el medio 4. Tabla 2
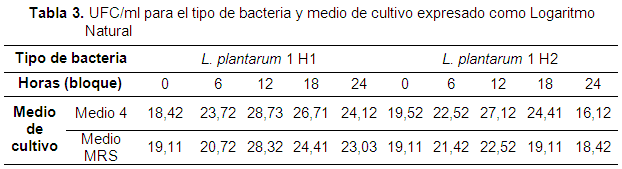
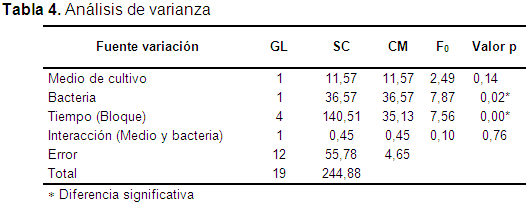
El tiempo sí influye en el proceso de crecimiento (UFC/ml), lo que lleva a tener en cuenta los efectos que se puedan generar de la interacción entre las bacterias y el medio de cultivo. Es posible que al controlar el efecto producido por el tiempo, el error experimental dentro de los tratamientos disminuya y permita una mejor comparación estadística entre los tratamientos (Tablas 3 y 4). Tabla 3-4
Se observa que no se presentaron diferencias estadísticamente significativas (p>0,05) entre el efecto de la interacción entre el medio de cultivo y las bacterias.
Dado que la interacción entre el medio de cultivo y las bacterias no es significativa, se evaluó cada factor por separado, donde el factor bacteria presentó diferencias estadísticamente significativas (p<0,05), mientras que el factor medio de cultivo no las presentó (p>0,05).
La evolución del pH en los medios 4 y MRS para L. plantarum 1 H1 presentó valores de 4,21 y 4,19 respectivamente a las 12 horas de efectuada la cinética. Para el caso de L. plantarum 1 H2 presentaron valores de 4,07 y 4,13 respectivamente. Para estos valores no presentó diferencias estadísticamente significativas (p>0,05).
El azúcar total en los medios 4 y MRS para L. plantarum 1 H1 presentó valores de 8,90 g/L y 6,41 g/L respectivamente a las 12 horas de efectuada la cinética. Para el caso de L. plantarum 1 H2 en los medios 4 y MRS presentó valores de 10,8 g/L y 4,07 g/L respectivamente. El sustrato del Medio 4 es usado de manera más eficiente en el crecimiento, que el MRS, por L. plantarum 1 H1 y H2, teniendo en cuenta que las concentraciones iniciales fueron iguales (15,1 g/L).
La producción de ácido láctico en los medios 4 y MRS para L. plantarum 1 H1 presentó valores de 17,66 g/L y 16,13 g/L respectivamente a las 12 horas de efectuada la cinética. Para el caso de L. plantarum 1 H2 presentó valores de 13,16 g/L y 17,09 g/L respectivamente (Tablas 5 y 6).
Esta alta viabilidad presentada por L. plantarum 1 y sus altas concentraciones de microorganismos (>107 UFC/g) (Vargas et al., 2004), serán un factor decisivo para que estos microorganismos realicen la colonización del tracto gastrointestinal en los lechones destetos contribuyendo a mejorar los recuentos de Lactobacillus en el tracto intestinal en experimentos in vivo (Gardiner et al., 2004). Tabla 5-6
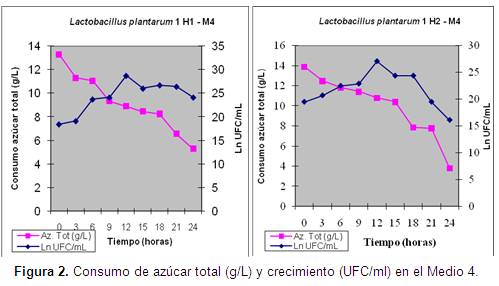
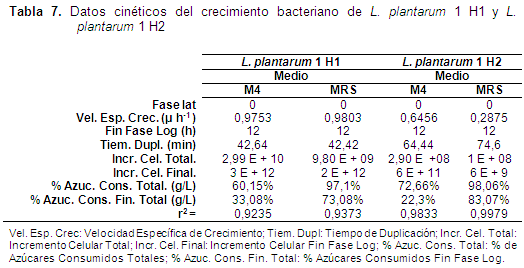
Los resultados de la producción de consumo de azúcar total (g/L) y de biomasa aparecen en las Figuras 1 y 2, y en la Tabla 7.
La tasa de rendimiento en el Medio 4 no fue calculada, por cuanto no fue posible la obtención real del peso seco de la biomasa, por la elevada cantidad de sólidos en suspensión. Estos sólidos son responsables por el incremento de la producción de biomasa viable en este medio, y esto se da por la mayor superficie de contacto que brindan para las bacterias. Este aspecto sería una razón importante para la investigación de los procesos relacionados con la producción de biomasa y para la elaboración de inóculos con propiedades probióticas.
Los productos para que sean considerados como probióticos, dependen de la legislación de cada país. Algunos señalan que deben contar con una población mínima de 106 UFC/ml, y otros señalan que debe tener la cantidad necesaria para que se ingiera una cantidad de 109 UFC/ml (Ouwehand et al., 2002). Sin embargo, para poder sostener los beneficios en la salud, la bacteria probiótica debe estar viable y disponible a altas concentraciones, por lo general, >106 UFC/g de producto (Puupponen-Pimiä et al., 2002). Así por ejemplo, aunque los sustratos favorecen de manera distinta a los microorganismos, se obtienen conteos por encima del criterio identificado para la industria láctea (1,0 x 106 UFC/ml). Teniendo en cuenta lo anterior, se pueden considerar los alimentos desarrollados como probióticos (FAO, 2010).
Los valores de pH encontrados a las 12 horas de cinética indican que L. plantarum 1 favorece los procesos de fermentación en la producción de inóculos. Este pH alcanzado en el Medio 4 y que corresponde al pH del medio intestinal de los lechones, es debido muy probablemente a que son bacterias aisladas del intestino de cerdos y que harían que se adapten más fácilmente en el tracto gastrointestinal debido a la especificidad del hospedero (Prescott et al., 2002).
Con estos valores de pH las bacterias probióticas aisladas podrán sobrevivir al tránsito a través del estómago, en donde la secreción de ácido gástrico constituye un mecanismo de defensa primario contra la mayoría de los microorganismos. Por consiguiente, L. plantarum se considera un probiótico único, por su capacidad de soportar valores de pH más bajos que la mayoría de otros microorganismos y por esta razón es común encontrarlo en alimentos fermentados naturalmente (Cebezi & Gürakan, 2003). Esta capacidad de resistir estas condiciones de acidez, se da por mecanismos celulares (como bombas de extracción de protones) para mantener el pH intracelular próximo a la neutralidad; siendo el L. plantarum 1 una de las cepas de mayor capacidad y uso probiótico (Cebezi & Gürakan, 2003).
Teniendo en cuenta que L. plantarum pertenece a la misma familia de Lactobacillus que se encuentran en el intestino de los lechones, se podrían obtener buenos resultados al alimentar los lechones a partir del destete con los probióticos seleccionados que incluyan estas especies de bacterias lácticas, y así, se podrá mantener un pH ácido, que puede determinar un fenómeno de inhibición microbiana a lo largo del tracto intestinal, previniendo un desorden gastrointestinal (Iñiguez et al., 2007).
Estos resultados indican que estos microorganismos son óptimos para ser utilizados en la preparación de inóculos, por cuanto a las 12 horas de la cinética, en el cual las dos bacterias alcanzan la fase exponencial de crecimiento, disponen de una concentración suficiente para mantener esta fase logarítmica, es decir, mantener una viabilidad alta en el tiempo. Según Ben et al. (2008), el Lactobacillus plantarum puede utilizar oligosacáridos como estaquiosa y rafinosa durante la fermentación. La leche de soya es una buena fuente de sacarosa, rafinosa y estaquiosa, así como de proteínas y magnesio. Durante la fermentación, más del 60% del contenido inicial de estaquiosa, rafinosa y sacarosa en la leche de soya se metaboliza por las bacterias y para el caso de Lactobacillus plantarum estos investigadores obtuvieron viabilidades de 1,0 x 109 UFC/ml al final de las fermentaciones.
Esta capacidad parece estar en parte vinculada a la síntesis de enzima α-galactosidasa que podría hidrolizar α-galactósidos (estaquiosa y rafinosa) durante la fermentación (Connes et al., 2004). Esto confirma los resultados obtenidos en esta investigación, según los cuales, L. plantarum 1 crece adecuadamente en medios (como el Medio 4) cuya composición tiene leche de soya (Nguyen et al., 2003; Pyo et al., 2005). Los probióticos deben ser viables en el alimento en concentraciones de 106-1011 UFC/ml, durante el tiempo de vida útil, coincidiendo con los resultados encontrados en el estudio de cinética (Collado et al., 2007).
En general, para que L. plantarum 1 se implante y colonice los enterocitos, es indispensable que disponga de una dieta rica en sustratos prebióticos, algunos de estos son de naturaleza lignocelulósica (oligosacáridos, fructooligosacáridos, fibra, cereales), derivados de la lactosa (galactooligosacáridos, lactulosa, lactitol), inulina, entre otros, coincidiendo con el prebiótico salvado de trigo (fibra insoluble) utilizado en esta investigación (Bielecka et al., 2002; Holzapfel & Schillinger, 2002).
Esta versatilidad de Lactobacillus plantarum se debe al tamaño de su genoma, el cual es 50% más grande que la mayoría de BAL y tiene una gran capacidad metabólica, que le permite utilizar una gran variedad de fuentes de carbono; propiedad que resulta de un gran número de genes involucrados en el transporte y utilización de azúcar, y un versátil metabolismo del piruvato, el cual tiene el potencial de producir D y L-lactato, formato, acetato, etanol, acetoína y 2,3-butanediol (Ljungh & Wadstrom, 2009).
Una característica importante del género Lactobacillus es su capacidad de producir ácido láctico y que tiene una influencia directa en el descenso de pH presentado en el Medio 4 (M4) y MRS. Esta producción de ácido láctico se da a partir de la fermentación de las hexosas a ácido láctico por la vía Embden-Meyerhof, o bien ciertas bacterias, con producción de ácido láctico, ácido acético, etanol y ácido fórmico. Esta fermentación también se puede dar a partir de las pentosas hasta ácido láctico y ácido acético por la vía de fosfocetolasa inducible. Entre estos microorganismos está L. plantarum (Llanes et al., 2007).
Uno de los más importantes mecanismos por el cual las BAL inhiben a sus competidores se da por la producción de ácido láctico, acético y bacteriocinas. La producción de ácido láctico por parte de L. plantarum 1 es un factor importante debido a que los lechones destetos presentan una inadecuada capacidad para la acidificación. La producción de ácido láctico y acético posee un efecto inhibitorio y esto se relaciona con la estructura no disociada de la molécula, siendo esta capaz de difundirse a través de la membrana celular y disociarse en su interior para provocar la muerte de la bacteria patógena. De esta manera, a los dos días de destetados los lechones gran número de coliformes proliferan en el tracto intestinal y está fuertemente correlacionado al aumento del pH del contenido ileal, al tiempo que los Lactobacillus están reducidos debido a la colonización y proliferación de E. coli por un posible bloqueo de sus receptores intestinales y secreción de tóxicos metabólicos. Es así, como, el cerdo lactante emplea muchas formas para vencer la limitación de la insuficiente secreción ácida; la primera estrategia implica la conversión de lactosa de la leche de la madre a ácido láctico por los Lactobacillus que se encuentran en el estómago; la segunda, el cerdo lactante reduce la necesidad de la secreción de grandes cantidades de ácido transitoriamente por la ingestión frecuente de pequeñas cantidades de alimento (Iñiguez et al., 2007).
La producción de ácido láctico se dio a una temperatura de 32°C y con buenos valores a las 12 horas, y Orozco y Solarte (2003) sostienen que a 30°C es una temperatura óptima, usando pentosas como sustrato, presentando la producción de ácido láctico racémico. Esta producción se incrementa simultáneamente al consumo de azúcares, dándose hasta el agotamiento del azúcar en el medio, incluso luego del crecimiento celular se continúa produciendo este metabolito. Según lo anterior, se puede clasificar la fermentación como in batch tipo I, pues la formación de ácido láctico deriva directamente del metabolismo primario utilizado para la producción de energía (Zhan et al., 2007).
El Medio 4 (M4), resultó ser el más adecuado para la elaboración de los inóculos, ya que durante el proceso de fermentación efectuado las dos cepas evaluadas alcanzaron los valores mayores de μh-1. Sin embargo, entre las dos bacterias la mejor μh-1 fue para L. plantarum 1 H1 y por tanto, el tiempo de duplicación celular es menor, lo que se ve reflejado en una mayor concentración celular en la fase logarítmica a las 12 horas. Se evidencia una clara diferencia con respecto al Medio MRS, por cuanto, en este medio los valores de μh-1 fueron inferiores para los dos microorganismos y con diferencia significativa para L. plantarum 1 H2 que mostró un valor de 0,2875 (μh-1), lo que indica que usar este Medio comercial para elaborar los inóculos no sería viable debido a que presentaría un tiempo de duplicación celular muy elevado, lo que implica que al llegar a la fase logarítmica la concentración celular será mucho menor, con respecto al Medio 4. Además, confirmaría que son 2 cepas diferentes y que L. plantarum 1 H1 tendría una mejor capacidad metabólica para utilizar este sustrato (M4 y MRS). En cuanto a que L. plantarum H2 sería más exigente referente al sustrato ya que necesitaría de una mayor fuente de carbohidratos como los proporcionados por la leche de soya, como lo son la rafinosa y la estaquiosa.
Por otro lado, los costos de producción del Medio 4 (M4) y MRS, son de gran interés por cuanto es factible el proceso de producción a nivel industrial de estos inóculos para estos microorganismos. De esta manera, el costo de 500 gramos del Medio comercial MRS es aproximadamente de US$ 170,44, y el costo de elaboración de un litro de este Medio comercial es de US$ 19,88; mientras, que el costo de la materia prima para la producción de un litro de inóculo con el Medio 4 fue de US$ 0,84.
En conclusión, Lactobacillus plantarum 1 mostró en el Medio 4 (10 g/L azúcar blanco, 15 g/L leche de soya, 150 g/L suero de leche, 15 g/L salvado de trigo) ser adecuado para la elaboración de inóculos con características probióticas que podrían ser utilizados en estudios posteriores para mejorar la salud y producción al ser incluidos en la alimentación para los lechones destetos.
Agradecimientos
A la empresa CERVALLE por la financiación de este proyecto de investigación. A la Escuela de Ingeniería de Alimentos de la Universidad del Valle; al Dr. Germán Bolívar. A todas las personas que de una u otra manera colaboraron en esta investigación.
Referencias Bibliográficas
· Axelsson, L. Lacticacid bacteria: classification and physiology. In: Salminen, S.; Von Wright, A.; Ouwehand, A. (Ed). Lactic Acid Bacteria. New York: Marcel Dekker, 2004. p.61-66. · Ben, W.; Champagne, CP.; Makhloufa, J. et al. Utilization of tofu whey pre-treated by electromembrane process as a growth medium for Lactobacillus plantarum LB17. Desalination, v. 229, p.192-203, 2008. · Bielecka, M.; Biedrzycka, E.; Majkowska, A. Selection of probiotics and prebiotics for synbiotics and confirmation of their in vivo effectiveness. Food Reseacher Institute, v.35, n.2-3, p.125-131, 2002. · Brizuela, M. Selección de cepas de bacterias ácido lácticas para la obtención de un preparado con propiedades probióticas y su evaluación en cerdos. La Habana, Cuba: Instituto Cubano de los Derivados de la Caña de Azúcar, ICIDCA, 2003. 200p. Tesis doctoral. · Cebezi, A.; Gürakan, C. Properties of potential probiotic Lactobacillus plantarum strains. Food Microbiology, v.20, p.511-518, 2003. · Collado, M.; Meriluoto, J.; Salminen, S. Measurement of aggregation properties between probiotics and pathogens: in vitro evaluation of different methods. Journal of Microbiology Methods, v.71, n.1, p.71-74, 2007. · Connes, C.; Silverstroni, A.; Leblanc, J. et al. Towards probiotic lactic acid bacteria strains to remove raffinose-type sugars present in soy-derived products. Dairy Science and Technology, v.84, p.207-214, 2004. · Crueger, W.; Crueger, A. Biotecnología: Manual de Microbiología Industrial. 3a ed. Madrid: Acribia, 1993. · Dubois, M.; Hamilton J.K.; Rebers, P.A. et al. Colorimetric method for determination of sugar and related substances. Analytical Chemestry, v.28, p.350-356, 1956. · Gardiner, G.; Casey, P.; Casey, G. et al. Relative Ability of Orally Administered Lactobacillus murinus To Predominate and Persist in the Porcine Gastrointestinal Tract. Applied Environmental Microbiology, v.70, p.1895-1906, 2004. · Holzapfel, W.; Schillinger, U. Introduction to pre-and probiotics. Food Research International, v.35, n.2-3, p.109-116, 2002. · Iñiguez, C.; Pérez, R.; Acedo, E. Evaluation of probiotics properties in Lactobacillus isolated from small intestine of pigltes. Revista Latinoamericana de Microbiología, v.49, p.3-4, 2007. · Kaban, G.; Kaya, M. Effect of starter culture on growth of Staphylococcus aureus in sucuk. Food Control, v.17, n.10, p.797-801, 2006. · Ljungh, A.; Wadstrom, T. Lactobacillus Molecular Biology From Genomics to Probiotics. Norfolk: Caister Academic Press, 2009. · Llanes-Iglesias, J.; Toledo-Pérez, J.; Fernández-Valdez, I. et al. Estudio del ensilado biológico de pescado como inóculo de bacterias lácticas en la conservación de desechos pesqueros. Revista Electrónica de Veterinaria, v.8, n.9, p.1-6, 2007. · Mack, D.; Ahrné, S.; Hyde, L. et al. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut, v.52, p.827-833, 2003. · Montes, A.; Santacruz, A.; Sañudo, J. Efecto in vitro de Lactobacillus casei subsp. rhamnosus sobre el crecimiento de un aislado de Helicobacter pylori. San Juan de Pasto, Colombia: Universidad de Nariño, 2003. 85p. Trabajo de grado (Biólogo). · Nguyen, L.; Champagne, C.; Lee, B. et al. Growth of Lactobacillus paracasei ssp. paracasei on tofu whey. International Journal of Food Microbiology, v.89, p.67-75, 2003. · Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). Programa Conjunto FAO/OMS Sobre Normas Alimentarias. Comisión del Codex Alimentarius. Informe de la FAO/OMS. Ginebra: FAO/OMS, 2010. 33º período de sesiones. · Orozco, M.; Solarte, J. Búsqueda del mejor medio de cultivo y modelamiento cinético para la obtención del ácido láctico a partir de glucosa por vía fermentativa. Manizales: Universidad Nacional de Colombia, 2003. 104p. Trabajo de grado (Ingeniería Química). · Ouwehand, A.; Salminen, S.; Isolauri, E. Probiotics: an overview of beneficial effects. Antonie Van Leeuwenhoek, v.82, n.1-4, p.279-289, 2002. · Prescott, L.; Harley, J.; Klein, D. Normal microbiota and nonspecific host resistance in Microbiology. 5 ed. Madrid: McGraw-Hill-Interamericana, 2002. · Puupponen-Pimiä, R.; Oksman-Caldentey, K.; Myllärinen, P. et al. Development of functional ingredients for gut health. Trends in Food Science & Technology, v.13, n.1, p.3-11, 2002. · Pyo, H.; Lee, TC.; Lee, Y. Enrichment of bioactive isoflavones in soymilk fermented with ß-glucosidase-producing lactic acid bacteria. Food Research International, v.38, n.5, p.551-559, 2005. · Ramírez, C. Uso de bactérias lácticas probióticas na alimentação de camarões Litopenaeus vannamei como inibidoras de microrganismo spatogênicos e estimulantes do sistema imune. Curitiba: Universidade Federal do Paraná, 2005. 190p. Tesis doctoral. · Rodríguez, J.; Bueno, G.; Rodríguez, D. et al. True and apparent yields and maintenance coefficient and their significance on fermentation kinetics. In: Roussos, S. (Ed). New Horizons in Biotechnology. Marseille: Kluwer Academic Pub, 2004. p.163-172. · Vargas, E.; Gómez, C.; Parra, M. et al. Producción de microorganismos probióticos como aditivo para alimentos concentrados para ganado vacuno (primera parte). Revista de Ingeniería, v.20, p.23-33, 2004. · Zamudio, K.; Zavaleta, A. Estudio del potencial probiótico de lactobacilos aislados de fuentes naturales. Ciencia e Investigación, v.6, n.1, p.30-35, 2003. · Zhan, Y.; Bon, J.; Joan, K. Production of lactic acid from renewable materials by Rhizopus fungi. Biochemical Engineering Journal, v.35, p.251-263, 2007.
Jurado-Gámez, H.; Ramírez, C.; Aguirre, D. Cinética de fermentación de Lactobacillus plantarum en un medio de cultivo enriquecido como potencial probiótico. Veterinaria y Zootecnia, v.7, n.2, p.37-53, 2013. <http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=118> |